
【题目】1911年,卢瑟福根据![]() 粒子散射实验结果提出了
粒子散射实验结果提出了
A.近代原子论B.原子结构的葡萄干面包模型
C.原子结构的行星模型D.核外电子排布规则
【答案】C
【解析】
A.1808年,英国科学家道尔顿提出了原子论.他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割,故A错误;
B.1897年,英国科学家汤姆逊发现原子中存在电子,最早提出了葡萄干蛋糕模型又称“枣糕模型”,也称“葡萄干面包”,1904年汤姆逊提出了一个被称为“西瓜式”结构的原子结构模型,电子就像“西瓜子”一样镶嵌在带正电的“西瓜瓤”中,故B错误;
C.1911年英国科学家卢瑟福用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来.在α粒子散射实验的基础上提出了原子行星模型,故C正确;
D.核外电子排布规则是指介绍原子核外电子的排布规律,主要有泡利不相容原理、能量最低原理、洪特定则,不是由卢瑟福根据![]() 粒子散射实验提出的,故D错误;
粒子散射实验提出的,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】(1)现有以下物质:①NaCl晶体、②液态HCl、③CaCO3固体、④熔融KCl、⑤蔗糖、⑥铜、⑦CO2、⑧H2SO4。其中:属于电解质的是___,属于非电解质的是___(填序号)。
(2)丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g·cm-3,沸点约为55 ℃,分离水和丙酮时最合理的方法是____。
a.蒸发 b.分液 c.过滤 d.蒸馏
(3)如图所示,过滤操作中的一处错误是__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是( )

A. 该装置中电能转化为光能
B. 电路中每转移0.2mol电子,甲池溶液质量变化 3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中碳棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3-。回答下列问题:
(1)仪器a名称:____________。
(2)B瓶内装的物质是:_________。
(3)若NO能被Na2O2完全吸收,E装置中的现象为__________________。
(4)三颈烧瓶A中反应的化学方程式为______________________。
(5)C装置的作用是_________________________。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)某同学测定部分变质的Na2SO3样品中Na2SO3的含量(已知在酸性条件下IO3-能将SO32-氧化为SO42-,自身还原为I-):
①用电子天平称取16.00gNa2SO3固体配成l00mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000mol/L酸性KIO3溶液(硫酸酸化)滴定,三次平行实验所用标准液体积的平均值为24.00mL。则滴定终点时锥形瓶中产生的现象______________,写出与产生终点现象有关反应的离子方程式__________,样品中Na2SO3的质量分数为_________。(计算结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和和食盐水可制得重要化工产品。
(1)电解饱和食盐水的化学方程式为: ___________________________。
(2)电解饱和食盐水时,________极区附近溶液pH变大。
(3)和电源正极相连的电极为________极,得到的气体产品是________,检验方法及现象为_______________,检验涉及的反应方程式是__________________________。
(4)电解一段时间后,取阴极区溶液作实验,下列结论中错误的是________(填字母)
A.滴加紫色石蕊试液,溶液呈红色
B.滴加氯化镁溶液,有白色沉淀产生
C.加入石灰石,有气泡产生
D.先加足量硝酸,再滴加硝酸银溶液,若产生沉淀说明溶液中含有氯离于
(5)电解一段时间后,欲使溶液恢复到电解前的浓度和体积,可往电解后的溶液中加入(或通入)一定量的________(填字母)
A.NaCl固体 B.NaCl溶液 C.HCl气体 D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为___________。
(2)在CH2=CHCN中,碳原子的杂化方式有___________、___________,所含σ键数目和π键数目之比为___________。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小___________(由大到小,用H一R—H表示),其原因是___________。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是___________。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20 (1=10-8cm),则C60的晶体密度为___________g/cm3。
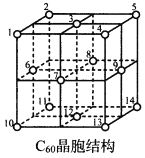
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有___________个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6. 4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是____________________;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)= __________;
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
|
|
图1 | 图2 |
①该小组同学提出的假设是__________________________________________;
②请你帮助该小组同学完成实验方案,并填完表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | 向试管中加入少量固体 | ||
4 | 3.0 | 2.0 | 3.0 | 2.0 | _____________ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com