
(14分)某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
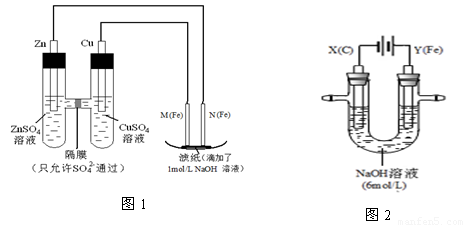
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- =FeO42- + 4H2O 和
4OH- - 4e- = 2H2O + O2↑ , 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(14分) (1)A (2分)
(2)2H+ + 2e- = H2↑(或2H2O + 2e- = H2↑+ 2OH-)(2分)
(3)从右向左(2分)
滤纸上有红褐色斑点产生(答出“红褐色斑点”或“红褐色沉淀”即可给分)(2分)
(4)增大 (2分)
(5)0.28 (2分)
(6)2FeO42- + 6e- + 5H2O = Fe2O3 + 10OH- (2分)
【解析】I.(1)图1是原电池,其中锌的活泼性强于铜的,所以锌是负极,铜是正极。因此在不改变电极反应的情况下,正极的材料的金属性不能强于锌,所以金属铝是不能的,答案选A。
(2)N电极和电源的负极相连,作阴极,溶液中的氢离子放电,生成氢气,电极反应式是2H+ + 2e- = H2↑。
(3)由于原电池中正极铜离子得到电子,负极锌失去电子,所以根据溶液的电中性可知,阴离子SO42-应该从从右向左移动;由于阳极铁失去电子,生成亚铁离子。而阴极氢离子放电,使溶液显碱性,从而生成氢氧化亚铁沉淀。氢氧化亚铁不稳定,极易钡氧化生成红褐色氢氧化铁沉淀,所以滤纸上能观察到的现象滤纸上有红褐色斑点产生。
II.(4)X电极和电源的负极相连,作阴极,溶液中的氢离子放电,生成氢气。从而破坏阴极周围水的电离平衡,所以X电极周围溶液显碱性。
(5)X电极氢气的物质的量是0.03mol,转移电子是0.06mol。Y电极生成的氧气的物质的量是0.0075mol,转移电子的物质的量是0.03mol,所以根据电子的得失守恒可知,铁失去的电子的物质的量是0.03mol,则根据电极反应式可知,消耗铁是0.005mol,质量是0.28g。
(6)原电池中正极得到电子,所以根据总的反应式可知,正极电极反应式是2FeO42- + 6e- + 5H2O = Fe2O3 + 10OH- 。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
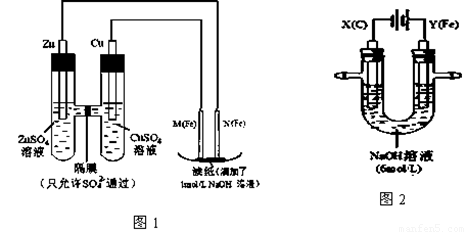
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- =FeO42- + 4H2O 和4OH- - 4e- = 2H2O + O2↑ , 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(7)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。

请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- =FeO42- + 4H2O 和4OH- - 4e- = 2H2O + O2↑ , 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(7)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广西桂林十八中高三上学期第一次月考化学试卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
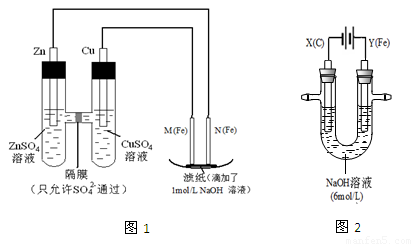
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- == FeO42- + 4H2O 和
。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为: K2FeO4 + 3Zn == Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com