
【题目】一定条件下,向容器的体积为4L的密闭容器中通入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后。试回答下列问题:
2NH3(g)△H<0,达到平衡后。试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=____________。 达到平衡后,若其它条不变,升高体系的温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),氮气的转化率将_______(“增大”、“减小”或“不变”,下同)。 若再通入1mol N2和3mol H2,氮气的转化率将 。
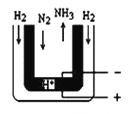
(3)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为
(4)三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 ;
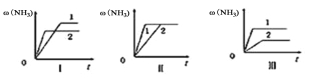
a.图Ⅰ可能是不同温度对反应的影响,且T2>T1
b.图Ⅲ可能是不同压强对反应的影响,且p1>p2
c.图Ⅱ可能是同温同压下,催化剂性能,1>2
【答案】(1)c2(NH3)/c(N2)·c3(H2) 减小
(2)不变,增大
(3)N2+6e-+6H+=2NH3
(4)abc
【解析】
试题分析:(2)N2(g)+3H2(g)![]() 2NH3(g)的平衡常数表达式K=
2NH3(g)的平衡常数表达式K=![]() ,正反应为放热反应,升高体系温度平衡逆向移动,平衡常数减小;
,正反应为放热反应,升高体系温度平衡逆向移动,平衡常数减小;
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),压强增大,但浓度不变,平衡不移动,氮气的转化率将不变, 若再通入1mol N2和3mol H2,平衡正向移动,氮气的转化率将增大;
(3)阴极发生还原反应,氮气在阴极获得电子,与电解质传导的H+结合生成氨气,阴极电极反应式为:N2+6e-+6H+=2NH3;
(4)a.升高温度反应速率加快,到达平衡时间缩短,故温度T2>T1,正反应为放热反反应,升高温度平衡逆向移动,氨气体积分数应减小,图象与实际相符,故a正确;b.增大压强反应速率加快,故压强p2>p1,但平衡正向移动,氨气体积分数增大,图象与实际相符,故b正确;c.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故c正确;故选abc。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】在通常条件下,下列各组物质的性质排列正确的是
A. Na、Mg、Al的第一电离能逐渐增大
B. 热稳定性:HF>H2O>NH3
C. S2﹣、Cl﹣、K+的半径逐渐增大
D. O、F、Ne的电负性逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)作为食品添加剂,具有无毒安全、价格低廉、效果明显等优点。回答有关CaO2的说法错误的是
A.具有氧化性 B.具有还原性 C.具有漂白性 D.含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3)。

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
表2原料价格表
物质 | 价格/元吨-1 |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(1)在步骤②中加入的试剂X,最佳的选择是______,其反应的离子方程式是 。
(2)在步骤③中如要控制pH=9.8,其目的是______;在步骤④中加入的试剂Y应是______;
(3)在步骤⑤中发生的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应属于加成反应的是( )
A.乙烯使酸性高锰酸钾溶液褪色
B.氢气和氯气光照下生成氯化氢
C.乙炔和氢气在催化剂下合成乙烷
D.乙烷和氯气光照下生成多氯代物和氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述正确的是
A.铜锌原电池中铜是阳极
B.用含有少量铜的银电极电解硝酸银溶液,金属铜在阳极不放电,直接形成阳极沉淀物
C.在镀件上电镀铜时用金属铜作阳极
D.在钢铁设备上装上若干铜块或锌块,可以有效的保护钢铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
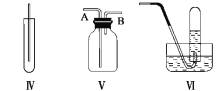
【题目】下图Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ是常见的气体制备,净化,收集装置,根据要求回答下列问题:
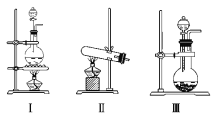
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_______,用化学方程式表示制取氯气的反应原理是______________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用发生装置__________,试完成并配平下列离子方程式:_____MnO4- + ____Cl- + ____H+ === ____Mn2+ + ____Cl2↑ + ____。
(3)若选用MnO2与浓盐酸反应制取的氯气含有杂质气体。可以选择 装置来除杂,装置中盛放的溶液依次为 和 。
(4)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是_______________________。
(5)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_____________________
(6)氯气有毒,可选择通过 溶液来处理尾气。发生的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com