
”¾ĢāÄæ”æµŖµÄ»ÆŗĻĪļŗĻ³É”¢Ó¦ÓĆ¼°µŖµÄ¹Ģ¶ØŅ»Ö±ŹĒæĘѧъ¾æµÄČČµć£®
£Ø1£©ŅŌCO2ÓėNH3ĪŖŌĮĻŗĻ³É»Æ·ŹÄņĖŲµÄÖ÷ŅŖ·“Ó¦ČēĻĀ£ŗ ¢Ł2NH3£Øg£©+CO2£Øg£©=NH2CO2NH4£Øs£©£»”÷H=©159.47kJmol©1
¢ŚNH2CO2NH4£Øs£©=CO£ØNH2£©2£Øs£©+H2O£Øg£©£»”÷H=a kJmol©1
¢Ū2NH3£Øg£©+CO2£Øg£©=CO£ØNH2£©2£Øs£©+H2O£Øg£©£»”÷H=©86.98kJmol©1
ŌņaĪŖ £®
£Ø2£©·“Ó¦2NH3£Øg£©+CO2£Øg£©CO£ØNH2£©2£Øl£©+H2O£Øg£© ŌŚŗĻ³ÉĖžÖŠ½ųŠŠ£®Ķ¼1ÖŠ¢ń”¢¢ņ”¢¢óČżĢõĒśĻßĪŖŗĻ³ÉĖžÖŠ°“²»Ķ¬°±Ģ¼±Č[ ![]() ]ŗĶĖ®Ģ¼±Č[
]ŗĶĖ®Ģ¼±Č[ ![]() ]Ķ¶ĮĻŹ±¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹµÄĒéæö£®
]Ķ¶ĮĻŹ±¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹµÄĒéæö£® 
¢ŁĒśĻߢń”¢¢ņ”¢¢óĖ®Ģ¼±ČµÄŹżÖµ·Ö±šĪŖ£ŗA.0.6”«0.7 B.1”«1.1 C.1.5”«1.61
Éś²śÖŠÓ¦Ń”ÓĆĖ®Ģ¼±ČµÄŹżÖµĪŖ£ØŃ”ĢīŠņŗÅ£©£®
¢ŚÉś²śÖŠ°±Ģ¼±ČŅĖæŲÖĘŌŚ4.0×óÓŅ£¬¶ų²»ŹĒ4.5µÄŌŅņæÉÄÜŹĒ £®
£Ø3£©ÄņĖŲæÉÓĆÓŚŹŖ·ØŃĢĘųĶѵŖ¹¤ŅÕ£¬Ęä·“Ó¦ŌĄķĪŖ£ŗ NO+NO2+H2O=2HNO2 2HNO2+CO£ØNH2£©2=2N2”ü+CO2”ü+3H2O£®
¢Łµ±ŃĢĘųÖŠNO”¢NO2°“ÉĻŹö·“Ó¦ÖŠĻµŹż±ČŹ±ĶѵŖŠ§¹ū×ī¼Ń£®ČōŃĢĘųÖŠV£ØNO£©£ŗV£ØNO2£©=5£ŗ1Ź±£¬æÉĶØČėŅ»¶ØĮæµÄæÕĘų£¬Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬V£ØæÕĘų£©£ŗV£ØNO£©=£ØæÕĘųÖŠŃõĘųµÄĢå»żŗ¬Įæ“óŌ¼ĪŖ20%£©£®
¢ŚĶ¼2ŹĒÄņĖŲŗ¬Įæ¶ŌĶѵŖŠ§ĀŹµÄÓ°Ļģ£¬“Ó¾¼ĆŅņĖŲÉĻæ¼ĀĒ£¬Ņ»°ćŃ”ŌńÄņĖŲÅضČŌ¼ĪŖ%£®
£Ø4£©Ķ¼3±ķŹ¾Ź¹ÓĆŠĀŠĶµē¼«²ÄĮĻ£¬ŅŌN2”¢H2ĪŖµē¼«·“Ó¦Īļ£¬ŅŌHCl©NH4ClĪŖµē½āÖŹČÜŅŗÖĘŌģ³ö¼ČÄÜĢį¹©ÄÜĮ棬Ķ¬Ź±ÓÖÄÜŹµĻÖµŖ¹Ģ¶ØµÄŠĀŠĶČ¼ĮĻµē³Ų£®ĒėŠ“³öøƵē³ŲµÄÕż¼«·“Ó¦Ź½ £® Éś²śÖŠæÉ·ÖĄė³öµÄĪļÖŹAµÄ»ÆѧŹ½ĪŖ £®
”¾“š°ø”æ
£Ø1£©+72.49
£Ø2£©A£»°±Ģ¼±ČŌŚ4.5Ź±£¬NH3µÄĮæŌö“ó½Ļ¶ą£¬¶ųCO2µÄ×Ŗ»ÆĀŹŌö¼Ó²»“ó£¬ĢįøßĮĖÉś²ś³É±¾
£Ø3£©1£ŗ1£»5
£Ø4£©N2+6e©+8H+=2NH4+£»NH4Cl
”¾½āĪö”æ½ā£ŗ£Ø1£©¢Ł2NH3£Øg£©+CO2£Øg£©=NH2CO2NH4£Øs£©£»”÷H=©159.47kJmol©1¢ŚNH2CO2NH4£Øs£©=CO£ØNH2£©2£Øs£©+H2O£Øg£©£»”÷H=a kJmol©1¢Ū2NH3£Øg£©+CO2£Øg£©=CO£ØNH2£©2£Øs£©+H2O£Øg£©£»”÷H=©86.98kJmol©1ŅĄ¾ŻČČ»Æѧ·½³ĢŹ½ŗĶøĒĖ¹¶ØĀÉ¢Ł+¢Ś=¢Ū£¬µĆµ½©159.47KJ/mol+a=©86.98KJ/mol
a=+72.49KJ/mol£»
ĖłŅŌ“š°øŹĒ£ŗ+72.49£»£Ø2£©¢Ł°±Ģ¼±ČĻąĶ¬Ź±ĒśĻߢń¶žŃõ»ÆĢ¼µÄ×Ŗ»ÆĀŹ“ó£¬ĖłŅŌÉś²śÖŠŃ”ÓĆĖ®Ģ¼±ČµÄŹżÖµĪŖA£»
ĖłŅŌ“š°øŹĒ£ŗA£»¢Ś°±Ģ¼±ČŌŚ4.5Ź±£¬ŠčŅŖ°±Ęų½Ļ¶ą£¬µ«ŅĄ¾ŻĶ¼Ļó·ÖĪö¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹŌö“󲻶ą£¬¹¤ŅµŗĻ³É°±Éś³É¹¤ŅÕ½Ļø“ŌÓ£¬ĢįøßÉś²ś³É±¾£»
ĖłŅŌ“š°øŹĒ£ŗ°±Ģ¼±ČŌŚ4.5Ź±£¬NH3µÄĮæŌö“ó½Ļ¶ą£¬¶ųCO2µÄ×Ŗ»ÆĀŹŌö¼Ó²»“ó£¬ĢįøßĮĖÉś²ś³É±¾£»£Ø3£©¢Łµ±ŃĢĘųÖŠNO”¢NO2°“ÉĻŹö·“Ó¦ÖŠĻµŹż±ČŹ±ĶѵŖŠ§¹ū×ī¼Ń£¬¼“1£ŗ1£¬ČōŃĢĘųÖŠV£ØNO£©£ŗV£ØNO2£©=5£ŗ1Ź±£¬ÉčĶØČėæÕĘųÖŠŃõĘųĢå»żĪŖx£»
Ōņ
2NO+ | O2= | 2NO2 |
2x | X | X |
![]() =1£ŗ1£¬
=1£ŗ1£¬
¼ĘĖćµĆµ½x=1
æÕĘųĢå»żĪŖ5
ĖłŅŌĶ¬ĪĀĶ¬Ń¹ĻĀ£¬V£ØæÕĘų£©£ŗV£ØNO£©=1£ŗ1
ĖłŅŌ“š°øŹĒ£ŗ1£ŗ1£» ¢ŚĶ¼Ļó·ÖĪöæÉÖŖ£¬µ±ÄņĖŲÅضČĪŖ5mol/L×óÓŅŹ±£¬ĶѵŖŠ§ĀŹ»ł±¾²»±ä£¬ĖłŅŌ“Ó¾¼ĆŅņĖŲÉĻæ¼ĀĒ£¬Ņ»°ćŃ”ŌńÄņĖŲÅضČŌ¼ĪŖ5%×óÓŅ“ó“ļµ½½Ļ“óµÄĶѵŖŠ§ĀŹ£»
ĖłŅŌ“š°øŹĒ£ŗ5%£»£Ø4£©ŅŌN2”¢H2ĪŖŌĮĻ£¬ŅŌHCl©NH4ClĪŖµē½āÖŹČÜŅŗ¹¹³ÉŠĀŠĶČ¼ĮĻµē³Ų£¬Õż¼«·¢Éś»¹Ō·“Ó¦£¬¼“µŖĘų±»»¹ŌÉś³ÉNH4+ £¬ µē¼«·“Ó¦Ź½ĪŖN2+6e©+8H+=2NH4+£»øŗ¼«ŹĒĒāĘųŹ§µē×ÓÉś³ÉĒāĄė×Ó£¬Õž¼ØÉś³Éļ§øłĄė×ÓŌŚµē½āÖŹČÜŅŗÖŠæÉŅŌ·ÖĄė³öĀČ»Æļ§£»
ĖłŅŌ“š°øŹĒ£ŗN2+6e©+8H+=2NH4+£» NH4Cl£»
”¾æ¼µć¾«Īö”æ±¾ĢāÖ÷ŅŖæ¼²éĮĖ»ÆŃ§Ę½ŗāדĢ¬±¾ÖŹ¼°ĢŲÕ÷µÄĻą¹ŲÖŖŹ¶µć£¬ŠčŅŖÕĘĪÕ»ÆŃ§Ę½ŗāדĢ¬µÄĢŲÕ÷£ŗ”°µČ”±¼“ VÕż=VÄę>0£»”°¶Æ”±¼“ŹĒ¶ÆĢ¬Ę½ŗā£¬Ę½ŗāŹ±·“Ó¦ČŌŌŚ½ųŠŠ£»”°¶Ø”±¼“·“Ó¦»ģŗĻĪļÖŠø÷×é·Ö°Ł·Öŗ¬Įæ²»±ä£»”°±ä”±¼“Ģõ¼žøÄ±ä£¬Ę½ŗā±»“ņĘĘ£¬²¢ŌŚŠĀµÄĢõ¼žĻĀ½ØĮ¢ŠĀµÄ»ÆŃ§Ę½ŗā£»ÓėĶ¾¾¶ĪŽ¹Ų£¬Ķā½ēĢõ¼ž²»±ä£¬æÉÄę·“Ó¦ĪŽĀŪŹĒ“ÓÕż·“Ó¦æŖŹ¼£¬»¹ŹĒ“ÓÄę·“Ó¦æŖŹ¼£¬¶¼æɽØĮ¢Ķ¬Ņ»Ę½ŗāדĢ¬£ØµČŠ§£©²ÅÄÜÕżČ·½ā“š“ĖĢā£®


 ³å“Ģ100·Ö1ŗžķĻµĮŠ“š°ø
³å“Ģ100·Ö1ŗžķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½ŲÖĮµ½2013Äź12ŌĀÄ©£¬ÖŠ¹ś¹ā·ü·¢µēŠĀŌö×°»śČŻĮæ“ļµ½10.66GW£¬¹ā·ü·¢µēĄŪ¼Ę×°»śČŻĮæ“ļµ½17.16GW£¬Ķ¼1ĪŖ¹ā·ü²¢Ķų·¢µē×°ÖĆ£®Ķ¼2ĪŖµē½āÄņĖŲ[CO£ØNH2£©2]µÄ¼īŠŌČÜŅŗÖĘĒāµÄ×°ÖĆŹ¾ŅāĶ¼£Øµē½ā³ŲÖŠøōĤ½ö×čÖ¹ĘųĢåĶعż£¬Ņõ”¢Ńō¼«¾łĪŖ¶čŠŌµē¼«£©£®ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ£Ø £© 
A.Ķ¼1ÖŠNŠĶ°ėµ¼ĢåĪŖÕż¼«£¬PŠĶ°ėµ¼ĢåĪŖøŗ¼«
B.Ķ¼2ČÜŅŗÖŠµē×ÓĮ÷Ļņ£ŗ“ÓB¼«Į÷ĻņA¼«
C.X2ĪŖŃõĘų
D.¹¤×÷Ź±£¬A¼«µÄµē¼«·“Ó¦Ź½ĪŖCO£ØNH2£©2+8OH©©6e©ØTCO32©+N2”ü+6H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌĻĀÓŠ»śĪļ·Ö×ÓÖŠÓŠĮ½ÖÖ¹ŁÄÜĶÅµÄŹĒ ( )
A. ŅŅĖį B. ŅŅ“¼ C. ŅŅĻ© D. ĀČŅŅĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆČēĶ¼×°ÖĆ£¬½ųŠŠNH3Óė½šŹōŃõ»ÆĪļMxOy·“Ӧɜ³ÉM”¢N2”¢H2O£¬Ķعż²āĮæÉś³ÉĖ®µÄÖŹĮæĄ“²ā¶ØMµÄĻą¶ŌŌ×ÓÖŹĮ森aÖŠŹŌ¼ĮŹĒÅØ°±Ė®£® 
£Ø1£©ŅĒĘ÷aµÄĆū³ĘĪŖ £¬ ŅĒĘ÷b֊װČėµÄŹŌ¼ĮæÉŅŌŹĒ £®
£Ø2£©°“ĘųĮ÷·½ĻņÕżČ·µÄ×°ÖĆĮ¬½ÓĖ³ŠņĪŖ£ØĢīŠņŗÅ£¬×°ÖĆæÉÖŲø“Ź¹ÓĆ£©£ŗ £®
£Ø3£©×°ÖĆCµÄ×÷ÓĆ£ŗ £®
£Ø4£©ŹµŃé½įŹųŹ±£¬Ó¦Ź×ĻČ£ØĢīŠņŗÅ£©£» ÕāŃł×öµÄŌŅņŹĒ £® ¢ń£®ĻØĆšA×°ÖĆµÄ¾Ę¾«µĘ¢ņ£®Ķ£Ö¹“ÓaÖŠµĪ¼ÓŅŗĢå
£Ø5£©Čō½šŹōŃõ»ÆĪļĪŖCuO£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
£Ø6£©ČōŹµŃéÖŠ×¼Č·³ĘČ”½šŹōŃõ»ÆĪļµÄÖŹĮæĪŖm g£¬ĶźČ«·“Ó¦ŗ󣬲āµĆÉś³ÉĖ®µÄÖŹĮæĪŖn g£¬ŌņMµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ£ØÓĆŗ¬x”¢y”¢m”¢nµÄŹ½×Ó±ķŹ¾£©£®
£Ø7£©Ä³Ķ¬Ń§×ŠĻø·ÖĪöÉĻŹö×°ÖĆŗóČĻĪŖČŌ“ęŌŚČ±ĻŻ£¬ÄćČĻĪŖøĆČēŗĪøĽų£æ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»ĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦N2+3H22NH3 £¬ ”÷H£¼0£¬“ļµ½Ę½ŗāŗó£¬Ö»øıäijŅ»øöĢõ¼žŹ±£¬·“Ó¦ĖŁĀŹÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼1ĖłŹ¾£ŗ 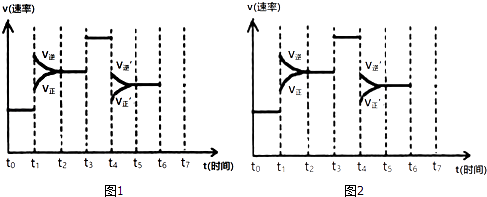
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©“¦ÓŚĘ½ŗāדĢ¬µÄŹ±¼ä¶ĪŹĒ£ØĢīŃ”Ļī£©£®
A.t0”«t1
B.t1”«t2
C.t2”«t3
D.t3”«t4
E.t4”«t5
F.t5”«t6
£Ø2£©t1”¢t3”¢t4Ź±æĢ·Ö±šøıäµÄŅ»øöĢõ¼žŹĒ£ŗt1Ź±æĢ£»t3Ź±æĢ£»t4Ź±æĢ £® £ØĢīŃ”Ļī£©£®
A£®Ōö“óŃ¹Ēæ B£®¼õŠ”Ń¹Ēæ C£®ÉżøßĪĀ¶Č
D£®½µµĶĪĀ¶Č E£®¼Ó“߻ƼĮ F£®³äČėµŖĘų
£Ø3£©ŅĄ¾Ż£Ø2£©ÖŠ½įĀŪ£¬ĻĀĮŠŹ±¼ä¶ĪÖŠ£¬°±µÄ°Ł·Öŗ¬Įæ×īøߵďĒ£ØĢīŃ”Ļī£©£®
A.t0”«t1
B.t2”«t3
C.t3”«t4
D.t5”«t6
£Ø4£©Ņ»¶ØĢõ¼žĻĀ£¬ŗĻ³É°±·“Ó¦“ļµ½Ę½ŗāŹ±£¬Čō½«ĆܱÕČŻĘ÷Ģå»żĖõŠ”Ņ»°ė£¬Ōņ¶Ō·“Ó¦²śÉśµÄÓ°ĻģŹĒ£ØĢīŃ”Ļī£©£®
A.Õż·“Ó¦ĖŁĀŹ¼õŠ”£¬Äę·“Ó¦ĖŁĀŹŌö“ó
B.Õż·“Ó¦ĖŁĀŹŌö“ó£¬Äę·“Ó¦ĖŁĀŹ¼õŠ”
C.Õż”¢Äę·“Ó¦ĖŁĀŹ¶¼¼õŠ”
D.Õż”¢Äę·“Ó¦ĖŁĀŹ¶¼Ōö“ó
£Ø5£©Čē¹ūŌŚt6Ź±æĢ£¬“Ó·“Ó¦ĢåĻµÖŠ·ÖĄė³ö²æ·Ö°±£¬t7Ź±æĢ·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬ĒėŌŚĶ¼2ÖŠ»³ö·“Ó¦ĖŁĀŹµÄ±ä»ÆĒśĻߣ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻæÉŅŌÓĆ·ĻĢśŠ¼Öʱø»īŠŌFe3O4 £¬ Į÷³ĢČēĶ¼1£ŗ 
£Ø1£©ŌŚÖʱø¹ż³ĢÖŠ£¬²»µ«ŅŖ½«æéד¹ĢĢåŌĮĻ·ŪĖ锢Ą³É·ŪÄ©£¬×÷ÓĆŹĒ £®
£Ø2£©ŌŚŗĻ³É³ŲĄļÉś³ÉFe3O4µÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø3£©øł¾ŻĮ÷³ĢæÉÖŖ£¬ÅäĮĻÖŠŠÄŗÜæÉÄÜŹ¹»ģŗĻĪļÖŠµÄFe2O3ÓėFeĪļÖŹµÄĮæÖ®±Č½Ó½ü £®
£Ø4£©Ä³Ķ¬Ń§ĄūÓĆ·ĻĢśŠ¼£Øŗ¬FeŗĶFe2O3£©Ą“ÖĘČ”FeCl36H2O¾§Ģ壬Ķ¬Ź±²ā¶Ø»ģŗĻĪļÖŠĢśµÄÖŹĮæ·ÖŹż£¬×°ÖĆČēĶ¼2£Ø¼Š³Ö×°ÖĆĀŌ£¬ĘųĆÜŠŌŅŃ¼ģŃ飩£ŗ ²Ł×÷²½ÖčČēĻĀ£ŗ
I£®“ņæŖµÆ»É¼ŠK1”¢¹Ų±ÕµÆ»É¼ŠK2 £¬ ²¢“ņæŖ»īČūa£¬»ŗĀżµĪ¼ÓŃĪĖį£®
¢ņ£®µ±”Ź±£¬¹Ų±ÕµÆ»É¼ŠK1“ņæŖµÆ»É¼ŠK2 £¬ µ±AÖŠČÜŅŗĶźČ«½ųČėÉÕ±ŗó¹Ų±Õ»īČūa£®
¢ó£®½«ÉÕ±ÖŠČÜŅŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖŗóµĆµ½FeC136H2O¾§Ģ壮
Ēė»Ų“š£ŗ
¢Ł²Ł×÷¢ņÖŠ”°””±µÄÄŚČŻŹĒ £¬ ÉÕ±ÖŠµÄĻÖĻóŹĒ £¬ ĻąÓ¦µÄ·½³ĢŹ½ŹĒ”¢_£®£ØŹĒĄė×Ó·“Ó¦µÄŠ“Ąė×Ó·½³ĢŹ½£©
¢ŚČō»ģŗĻĪļÖŹĮæĪŖm g£¬ŹµŃé½įŹųŗó²āµĆBÖŠĖłµĆµÄĘųĢåŹĒV mL£Ø±ź×¼×“æöŹ±£©£¬øĆĶ¬Ń§ÓÉ“Ė¼ĘĖć³ö“Ė·ĻĢśŠ¼ÖŠĢśµÄÖŹĮæ·ÖŹżŹĒ ![]() £¬øĆŹżÖµ±ČŹµ¼ŹŹżÖµĘ«µĶ£¬ČōŹµŃé¹ż³Ģ²Ł×÷ĪŽĪó£¬Ę«µĶµÄŌŅņŹĒ £®
£¬øĆŹżÖµ±ČŹµ¼ŹŹżÖµĘ«µĶ£¬ČōŹµŃé¹ż³Ģ²Ł×÷ĪŽĪó£¬Ę«µĶµÄŌŅņŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼øśÅØĮņĖį¹²ČČ²śÉśµÄĘųĢåXŗĶĶøśÅØĻõĖį·“Ó¦²śÉśµÄĘųĢåYĶ¬Ź±ĶØČėŹ¢ÓŠ×ćĮæĀČ»Æ±µČÜŅŗµÄĻ“ĘųĘæÖŠ£ØČēĶ¼ĖłŹ¾£©£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£© 
A.Ļ“ĘųĘæÖŠ²śÉśµÄ³ĮµķŹĒĢ¼Ėį±µ
B.“ÓZµ¼¹Ü³öĄ“µÄĘųĢåÖŠĪŽ¶žŃõ»ÆĢ¼
C.Ļ“ĘųĘæÖŠ²śÉśµÄ³ĮµķŹĒŃĒĮņĖį±µ
D.ŌŚZµ¼¹ÜæŚÓŠŗģ×ŲÉ«ĘųĢå³öĻÖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀČ¼ī¹¤ŅµŅŌµē½ā¾«Öʱ„ŗĶŹ³ŃĪĖ®µÄ·½·ØÖĘČ”ĀČĘų”¢ĒāĘų”¢ÉÕ¼īŗĶĀȵÄŗ¬ŃõĖįŃĪµČĻµĮŠ»Æ¹¤²śĘ·£®ČēĶ¼ŹĒĄė×Ó½»»»Ä¤·Øµē½āŹ³ŃĪĖ®µÄŹ¾ŅāĶ¼£¬Ķ¼ÖŠµÄĄė×Ó½»»»Ä¤Ö»ŌŹŠķŃōĄė×ÓĶعż£®Ķź³ÉĻĀĮŠĢīæÕ£ŗ
£Ø1£©Š“³öµē½ā±„ŗĶŹ³ŃĪĖ®µÄĄė×Ó·½³ĢŹ½ £®
£Ø2£©Ąė×Ó½»»»Ä¤µÄ×÷ÓĆĪŖ£ŗ”¢ £®
£Ø3£©¾«Öʱ„ŗĶŹ³ŃĪĖ®“ÓĶ¼ÖŠĪ»ÖĆ²¹³ä£¬ĒāŃõ»ÆÄĘČÜŅŗ“ÓĶ¼ÖŠĪ»ÖĆĮ÷³ö£®£ØŃ”Ģī”°a”±”¢”°b”±”¢”°c”±»ņ”°d”±£©
£Ø4£©KClO3æÉŅŌŗĶ²ŻĖį£ØH2C2O4£©”¢ĮņĖį·“Ӧɜ³Éøߊ§µÄĻū¶¾É±¾ś¼ĮClO2 £¬ »¹Éś³ÉCO2ŗĶKHSO4µČĪļÖŹ£®Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ £®
£Ø5£©ŹŅĪĀĻĀ£¬0.1mol/LNaClOČÜŅŗµÄpH0.1mol/LNa2SO3ČÜŅŗµÄpH£®£ØŃ”Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©
£Ø6£©ÅØ¶Č¾łĪŖ0.1mol/LµÄN2SO3ŗĶNa2CO3µÄ»ģŗĻČÜŅŗÖŠ£¬SO32©”¢CO32©”¢HSO3©”¢HCO3©ÅØ¶Č“Ó“óµ½Š”µÄĖ³ŠņĪŖ £®
£Ø7£©ĮŖ°±£ØÓÖ³ĘėĀ£¬N2H4 £¬ ĪŽÉ«ŅŗĢ壩ŹĒŅ»ÖÖÓ¦ÓĆ¹ć·ŗµÄ»Æ¹¤ŌĮĻ£¬æÉÓĆ×÷»š¼żČ¼ĮĻ£®»Ų“šĻĀĮŠĪŹĢā£ŗ ¢ŁĮŖ°±·Ö×ӵĵē×ÓŹ½ĪŖ £®
¢ŚŹµŃéŹŅÖŠæÉÓĆ“ĪĀČĖįÄĘČÜŅŗÓė°±·“Ó¦ÖʱøĮŖ°±£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £® 
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŖ·ĄÖ¹Ė®ĢåĪŪČ¾£¬øÄÉĘĖ®ÖŹ£¬×īøł±¾µÄ“ėŹ©ŹĒ £Ø””””£©
A.æŲÖĘ¹¤Ņµ·ĻĖ®µÄÅÅ·Å
B.¶ŌŗÓĖ®½ųŠŠĻū¶¾“¦Ąķ
C.æŲÖĘÅ©ĢļÅÅĖ®
D.¼õÉŁÓĆĖ®Įæ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com