
【题目】某元素一价阴离子,核外电子数是18,其原子的质量数是35,则核内中子数与质子数之差 ( )
A. 1 B. 0 C. 35 D. 17
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】![]() 表示阿伏伽德罗常数,下列判断正确的是( )
表示阿伏伽德罗常数,下列判断正确的是( )
A.在18![]() 中含有NA个氧原子
中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1 molCl2参加反应转移电子数一定为2NA
D.含![]() 个
个![]() 的
的![]() 溶解于1L水中,
溶解于1L水中,![]() 的物质的量浓度为1mol/L
的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制95mL 1 mol·L-1的稀硫酸。

可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的_______。

(2)配制稀硫酸时,除玻璃棒外还缺少的仪器是________________(写仪器名称);
(3)经计算,配制95mL1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为______mL,量取硫酸时应选用_________mL规格的量筒(填序号);
A.10 mL B.50 mL C.100 mL D.200mL
(4)取25 mL1 mol·L-1的硫酸,向其中加入一定量的氧化铜,充分反应后制得硫酸铜溶液。用该溶液制取CuSO4·5H2O,所需要的主要玻璃仪器除酒精灯、玻璃棒外,还缺少的仪器是___________;
(5)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因__________(填序号)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如下工艺流程法制得。
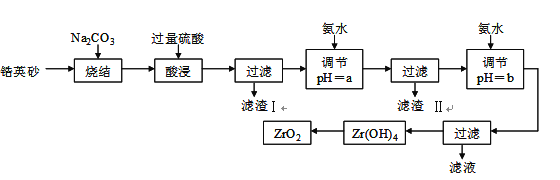
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。②部分金属离子开始沉淀和完全沉淀的pH如下表:
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀的pH | 1.9 | 3.3 | 6.2 |
沉淀完全的pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
⑴烧结时ZrSiO4发生反应的化学方程式为_______________________;
滤渣I的化学式为______________________________。
⑵调节pH=a 的目的是________________________________________;用氨水调节pH=b后发生反应的离子方程式为______________________________________________。
⑶以滤渣II为主要原料制取铁红,请简述实验方法________________________。
⑷工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:
________________________________________________________。
⑸一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入甲烷,写出负极的电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)工业上常用电解饱和食盐水的方法制备氯气,其装置如下图所示:

(1)写出电解饱和食盐水的化学方程式并在化学方程式上标出电子转移的方向和数目:_____。
(2)电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分振荡,最后观察到的现象是____________。
A.溶液分层,上层无色,下层橙红色
B.溶液分层,上层橙红色,下层无层
C.溶液分层,上层无色,下层紫红色
D.溶液分层,上层紫红色,下层无层
(3)用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式_______;____________________________。
(II)某同学对实验室制取氯气的装置进行改进,设计了制取无水氯化铁的实验装置图(如下),将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(4)烧瓶中发生反应的化学方程式____________________;
(5)产生的气体通过B、C装置,可以得到干燥纯净的氯气,B瓶中的试剂是_____________;
(6)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因为______________________________________。
(7)玻璃管D中反应现象是_________________;写出反应方程式______________________。
(8)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种元素,它们的单质X、Y、Z在常温常压下皆为气体,W为固体。
①X单质可在Z单质中燃烧生成XZ,其火焰为苍白色;W单质在Y单质中剧烈燃烧产生黄色火焰,生成W2Y2;
②每2molX2可与1molY2化合生成2molX2Y,X2Y在常温下为液体;
③化合物XZ的水溶液可使蓝色石蕊试纸变红;W与水反应后的溶液可使无色酚酞试液变红色;
④Z单质溶于化合物X2Y,所得溶液具有漂白作用;请回答:
(1)画出Z原子的原子结构示意图________;实验室中的W应保存在________中(填试剂名称)
(2)写出化学式W2Y2___________.
(3)写出与W+具有相同核外电子数的分子或原子,请写出任意2种的化学式______.
(4)Z单质与水反应的离子方程式:________________________。
(5)W单质与X2Y化学反应方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是_________反应,城市射灯在夜空形成五颜六色的光柱,属于______效应。
(3)在 2Na2O2+2CO2===2Na2CO3+O2反应中,_________是还原剂,_________是氧化剂。若转移3mol电子,则所产生的O2在标准状况下的体积为_________。
(4)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3 选用的试剂为________________________;
③除去Na2CO3粉末中的NaHCO3 ,采用的方法___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com