
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( ) 
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中,量筒中发生了加成反应
【答案】B
【解析】稀盐酸不与二氧化锰反应,所以当二氧化锰过量时,浓盐酸变稀后不再继续反应,最后剩余盐酸,A错;氯气溶于水生成次氯酸具有漂白性,使有色布条褪色,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,加入酸后氯离子与次氯酸根离子发生反应生成氯气,B对;铜在氯气中燃烧生成棕色的烟,C错;甲烷与氯气发生取代反应,D错。
【考点精析】认真审题,首先需要了解氯气的化学性质(氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应),还要掌握氯气的实验室制法(实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O)的相关知识才是答题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上处理含Cr2O![]() 的酸性工业废水用以下方法:
的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;③过滤回收沉淀,废水达排放标准。试回答:
(1)电解时的电极反应,阳极 , 阴极。
(2)写出Cr2O![]() 转变成Cr3+的离子反应方程式。
转变成Cr3+的离子反应方程式。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?。
(4)能否将Fe电极改成石墨电极?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
(1)基态硅原子的电子排布式
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷中硅采取 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 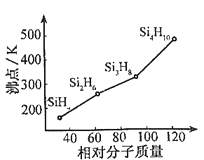
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为 .(用元素符号表示)
(4)气态SeO3分子的立体构型为 ,与SeO3互为等电子体的一种离子为 (填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞棱长为a pm,则该合金密度为 g/cm3 . (列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,2L气体XY2与1L气体Y2化合,生成2L气体化合物,则该化合物的化学式为 ( )
A.X3YB.X3Y2 C.X2Y3 D.XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2﹣和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 .
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 .
(3)X与Z中电负性较大的是 . Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是 , 此离子中含有的化学键类型是 , X﹣Z﹣X的键角109.5°.(填“>”“=”或“<”)(提示:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力).
(4)X与Y形成的化合物Y2X的晶胞如图.其中X离子的配位数为 , 以相距一个X离子最近的所有Y离子为顶点构成的几何体为 . 该化合物与MgO相比,熔点较高的是 . 
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为gcm﹣3 . (只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.实验室用下列有关装置先制取干燥、纯净的氯气,后进行有关性质实验。试回答下列问题。
(1)上述装置中各仪器从左至右的连接顺序为接接接接接接。
(2)E装置的作用是 , G装置的作用是 , D中的现象为 , B中的现象为
。
(3)写出下列反应的离子方程式:B中 , G中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法正确的是( )
A.所有原子都含有质子、中子和电子3种基本微粒
B.质子数决定元素的种类,中子数决定原子的种类
C.质子、中子和电子不可以进一步分成更小的微粒
D.1H、2H2、3H+不能互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com