
| A. | 用食醋除去暖水瓶中的薄层水垢 | |
| B. | 一般不用纯碱代替小苏打作食品发酵粉 | |
| C. | 用甲醛溶液浸泡海产品以保鲜 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
分析 A.醋酸可与碳酸钙反应;
B.纯碱性质稳定,加热不分解;
C.甲醛对人体有害;
D.蛋白质的性质与纤维素不同.
解答 解:A.醋酸具有酸性,可与碳酸钙反应,可用于除去水垢,故A正确;
B.纯碱一般不用于发酵,面团发酵后产生了酸,可生成二氧化碳,小苏打不稳定,分解生成二氧化碳,其面团不需要事先发酵,故B正确;
C.甲醛对人体有害,不能用于浸泡海产品,故C错误;
D.蛋白质的性质与纤维素不同,灼烧时蛋白质具有烧焦的羽毛气味,故D正确.
故选C.
点评 本题综合考查物质的性质与应用,为高频考点,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:实验题
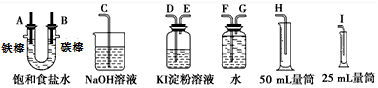
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 9 | C. | 12 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
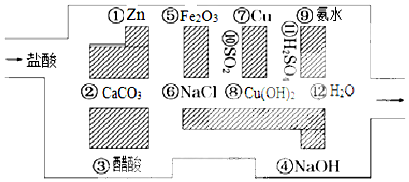
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.
某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
| 试验编号 | 待测盐酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 20.00 |
| ② | 25.00 | 1.10 | 21.30 |
| ③ | 25.00 | 0.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com