
| A. | 用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 | |
| D. | 改用移液管取10.00mLNaOH溶液,放入锥形瓶后,把移液管尖嘴处液体吹入 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A、用蒸馏水冼净滴定管后,装入标准盐酸进行滴定,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故A错误;
B、用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故B错误;
C、用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定,V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)无影响,故C正确;
D、改用移液管取10.00mLNaOH溶液,放入锥形瓶后,把移液管尖嘴处液体吹入,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故D错误;
故选C.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
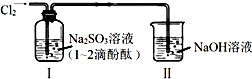
| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 导气管末端不应该伸入到液面以下 | |
| D. | 若将装置Ⅰ中Na2SO3改成NaOH溶液,现象完全相同 |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:填空题
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
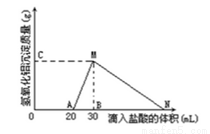
(1)此溶液中同时含有____________mol______离子;
(2)用离子方程式表示MN段发生的反应是________________________
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)________________
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为__________mL
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2 粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )
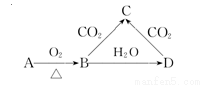
A.溶液呈碱性
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH溶液体积(mL) | 待测盐酸的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
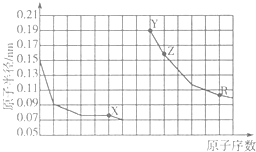
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极应与X相连接 | |
| B. | H+透过质子交换膜由左向右移动 | |
| C. | M电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com