
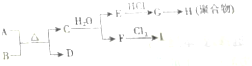
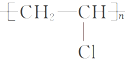 ;
;分析 A为黑色固体单质,B为煅烧石灰石的固体产物,应为CaO,D可以还原氧化铜,E是常用于切割和焊接金属的可燃性气体,应为C2H2,则可知A为碳,与CaO反应生成C为CaC2,D为CO,F为Ca(OH)2,G为CH2=CHCl,H为聚乙烯,I为漂白粉或漂白精,以此解答该题.
解答 解:A为黑色固体单质,B为煅烧石灰石的固体产物,应为CaO,D可以还原氧化铜,E是常用于切割和焊接金属的可燃性气体,应为C2H2,则可知A为碳,与CaO反应生成C为CaC2,D为CO,F为Ca(OH)2,G为CH2=CHCl,H为聚乙烯,I为漂白粉或漂白精,
(1)由以上分析可知C为CaC2,俗称电石,与水反应生成乙炔和氢氧化钙,方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,
故答案为:电石;CaC2;CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)E→G,G→H的反应类型分别为加成反应和加聚反应,H为聚氯乙烯,结构简式为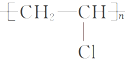 ,
,
故答案为:加成反应;加聚反应;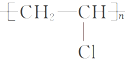 ;
;
(3)某物质与C2H2具有相同的最简式,即CH,它在一定条件下可以与浓H2SO4,浓HNO3的混酸发生取代反应,可以与H2发生加成反应,但不被酸性KMnO4氧化,应为苯,分子式为C6H6,因含碳量高,则在空气中燃烧的现象为火焰明亮,伴有浓烟,
故答案为:C6H6;火焰明亮,伴有浓烟;
(4)F→I是工业上生产漂白精的主要原理,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,解答本题,注意常见物质的性质以及反应的特点和物质的重要用途,学习中主要相关基础知识地积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:
工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
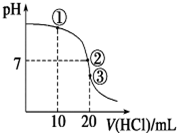 常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )
常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| C. | ①、②、③三点所示的溶液中水的电离程度②>③>① | |
| D. | 滴定过程中不可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
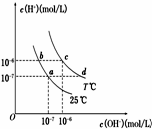 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:Fe3+、Ba2+、K+、NO3- | |
| B. | b点对应的溶液中大量存在:Na+、K+、NH4+、Cl- | |
| C. | d点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | c点对应的溶液中大量存在:CO32-、Na+、Cu2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基中含有的电子数为10NA | |
| B. | 1mol乙醇中含有C-H键的数目为6NA | |
| C. | 300mL2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| D. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com