
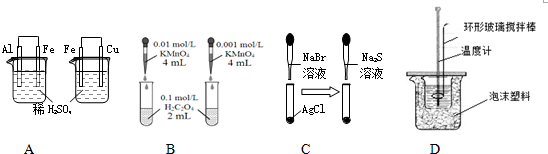
| A. | 依据左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡,判断活动性:Al>Fe>Cu | |
| B. | 依据褪色快慢比较浓度对反应速率的影响 | |
| C. | 依据白色固体先变为淡黄色,后变为黑色(Ag2S),判断溶解性:AgCl>AgBr>Ag2S | |
| D. | 用该装置测定中和热 |
分析 A.左烧杯中铁为正极,右边烧杯中铜为正极,活泼金属作负极;
B.反应生成的锰离子可能加快反应速率;
C.发生沉淀的转化;
D.泡沫塑料可保温,温度计测定温度,环形搅拌棒可搅拌混合液.
解答 解:A.左烧杯中铁为正极,右边烧杯中铜为正极,正极上均生成氢气,活泼金属作负极,可知活动性:Al>Fe>Cu,故A正确;
B.反应生成的锰离子可能加快反应速率,则浓度、催化剂两个变量,不能判定影响反应速率的因素,故B错误;
C.发生沉淀的转化,向溶解度更小的方向移动,可知溶解性:AgCl>AgBr>Ag2S,故C正确;
D.泡沫塑料可保温,温度计测定温度,环形搅拌棒可搅拌混合液,则图中装置可测定中和热,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握电化学、反应速率、沉淀转化及中和热测定、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大 | |
| B. | 25℃时,0.1mol•L-1的HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-3mol•L-1 | |
| C. | 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 25℃时,沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+Ca(OH)2=CaCO3↓+H2O | B. | SO3+H2O=H2SO4 | ||
| C. | 2KMnO4=K2MnO4+MnO2+O2↑ | D. | 2NaHCO3=Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在氯气中燃烧,有白雾生成 | |
| B. | 铜在氯气中燃烧,生成蓝色的氯化铜颗粒 | |
| C. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 氢气在氯气中燃烧产生大量的白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和盐酸的反应:CO32ˉ+2H+═CO2↑+H2O | |
| B. | KI溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| C. | 三氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| D. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OHˉ═SiO32ˉ+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 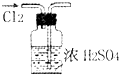 干燥Cl2 | B. | 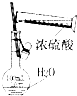 配制100ml 0.1mol•L-1硫酸溶液 | ||
| C. | 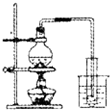 制取少量蒸馏水 | D. | 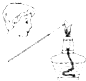 检验钾元素的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | H3PO4溶于水:H3PO4?3H++PO43- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
不能判断甲比乙非金属性强的事实是( )
A. 常温下甲能与氢气直接化合,乙不能
B. 甲的氧化物对应的水化物酸性比乙强
C. 甲得到电子能力比乙强
D. 甲、乙形成的化合物中,甲显负价,乙显正价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com