
����Ŀ��ˮú����һ�ֵ���ֵú������Ҫ�ɷ�ΪH2��CO����Ҫ��Ϊ��ҵ�Ϻϳɰ���Һ��ȼ�ϵ�ԭ�ϣ�
��1����ӦCO��g��+H2O��g��CO2��g��+H2��g����H=��41KJ/mol��v��tͼ����ͼ1��ʾ���������������䣬ֻ���ڷ�Ӧǰ��С���ʹѹǿ��������v��tͼ����ͼ2��ʾ�� 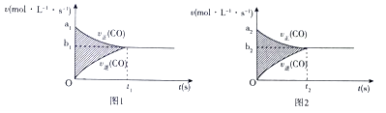
����˵����ȷ����
��a1��a2 ��a1��a2 ��b1��b2 ��b1��b2 ��t1��t2 ��t1=t2 ����ͼ����Ӱ���������� ��ͼ2��Ӱ�����������
A.�٢ܢݢ�
B.�٢ۢޢ�
C.�ڢܢݢ�
D.�ڢܢݢ�
��2����һ���¶��½�C���ʺ�CO2��g����0.10mol�������Ϊ1L�ĺ����ܱ������з�����ӦC��s��+CO2��g��2CO��g����H=+172KJ/mol��
������ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ���Ѿ��ﵽ��ѧƽ��״̬����������ţ���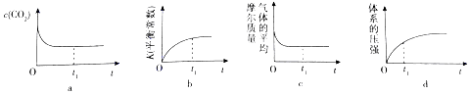
�ڴﵽƽ��ʱ�������ڵ�ѹǿΪ��ʼʱ��1.5�������ʱ��Ӧ�Ļ�ѧƽ�ⳣ��K=������ʱ�ٷֱ����0.05mol��CO2��0.1mol��CO�����ʱƽ�⽫������ơ��������ơ����ƶ������������÷�Ӧ����ʼ������Ϊ���º�ѹ����ﵽƽ��ʱ��CO2��ת���ʽ����������С�����䡱����
��3����ҵ���ý�̿��ˮ�����Ʊ�ˮú�����Ȼ�ѧ����ʽΪ
��4����һ����������CO��H2Ϊԭ�Ͽ��Ժϳ��Ҵ�����Ӧ����ʽΪ��2CO��g��+4H2��g��CH3CH2OH��g��+H2O��g����H=aKJ/mol��
��ӷ�Ӧ�ܷ��Է����еĽǶȽ���aһ��С��0��ԭ�� �� ��ֻ�ı䷴Ӧ��һ����������ʹƽ����ϵ��n ![]() ����Ĵ�ʩ����������㼴�ɣ�
����Ĵ�ʩ����������㼴�ɣ�
���𰸡�
��1��C
��2��ac�����ƣ�����
��3��C��s��+H2O��g��=CO��g��+H2��g����H=+131KJ/mol
��4���÷�Ӧ�ġ�S��0��ֻ�е���H��0ʱ������˹�����ܡ�G=��H��T��S���п���С��0����Ӧ������һ���������Է����У�����a��0�����£���ѹ������CO��Ũ��
���������⣺��1����ӦCO��g��+H2O��g��CO2��g��+H2��g����H=��41KJ/mol��v��tͼ����ͼ1��ʾ����Ӧǰ������������䣬�������������䣬ֻ���ڷ�Ӧǰ��С���ʹѹǿ��������Ũ������Ӧ�������ﵽƽ������ʱ����С����Ӱ����Ϊ��Ӧ��Ũ�ȱ仯����ͼ2��Ũ�ȱ仯��ͼ1��Ũ�ȱ仯�������ѡ��õ���a1��a2 �� b1��b2 �� t1��t2 �� ��ͼ����Ӱ�������ͼ2��Ӱ�����������ѡ��ڢܢݢ࣬��ѡC�����Դ��ǣ�C����2����a��t1ʱ���淴Ӧ������ͬ��˵����Ӧ�ﵽƽ��״̬����a��ȷ��
b��t1ʱƽ�ⳣ���������仯�����淴Ӧ���ʲ���ȣ�����˵���ﵽ��ƽ��״̬����b����
c����Ӧǰ�����������仯���������ӣ����ʵ�������t1ʱ����ƽ��Ħ���������䣬˵�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����c��ȷ��
d��t1������ѹǿ����ʼ�շ����仯���������淴Ӧ���ʲ���ȣ���Ӧ���ܴﵽƽ��״̬����d����
��ѡac��
���Դ��ǣ�ac������һ���¶��½�C���ʺ�CO2��g����0.10mol�������Ϊ1L�ĺ����ܱ������з�����Ӧ���������̼����Ũ��Ϊx��
C��s��+ | CO2��g�� | 2CO��g�� | ��H=+172KJ/mol | ||
��ʼ����mol/L�� | 0.10 | 0 | |||
�仯����mol/L�� | x | 2x | |||
ƽ������mol/L�� | 0.10��x | 2x |
�ﵽƽ��ʱ�������ڵ�ѹǿΪ��ʼʱ��1.5������0.10��x+2x=0.10��1.5��
x=0.05mol/L����ƽ�ⳣ��K= ![]() =0.2��
=0.2��
����ʱ�ٷֱ����0.05mol��CO2��0.1mol��CO����ʱŨ����Qc= ![]() =0.4��K=0.2�����ʱƽ�⽫���ƣ������÷�Ӧ����ʼ������Ϊ���º�ѹ���淴Ӧ�����������ʵ������ӣ�Ϊ���ֺ�ѹ�����������������ѹǿ��С��ƽ��������У���ﵽƽ��ʱ��CO2��ת���ʽ�����
=0.4��K=0.2�����ʱƽ�⽫���ƣ������÷�Ӧ����ʼ������Ϊ���º�ѹ���淴Ӧ�����������ʵ������ӣ�Ϊ���ֺ�ѹ�����������������ѹǿ��С��ƽ��������У���ﵽƽ��ʱ��CO2��ת���ʽ�����
���Դ��ǣ�0.2�����ƣ�����3����CO��g��+H2O��g��CO2��g��+H2��g����H=��41KJ/mol��
��C��s��+CO2��g��2CO��g����H=+172KJ/mol��
��˹���ɼ����+�ڵõ������Ȼ�ѧ����ʽ��C��s��+H2O��g��=CO��g��+H2��g����H=+131KJ/mol��
���Դ��ǣ�C��s��+H2O��g��=CO��g��+H2��g����H=+131KJ/mol����4����һ����������CO��H2Ϊԭ�Ͽ��Ժϳ��Ҵ�����Ӧ����ʽΪ��2CO��g��+4H2��g��CH3CH2OH��g��+H2O��g����H=aKJ/mol��
����Ӧ�Է����С�G=��H��T��S��0����Ӧǰ�����������С����S��0��ֻ�е���H��0ʱ������˹�����ܡ�G=��H��T��S���п���С��0������a��0��
�ı�����ʹ��ֵ ![]() ����ƽ����Ҫ������У���Ӧ�Ƿ��ȷ�Ӧ���Խ����¶ȣ���Ӧǰ�����������С����������ѹǿ��Ҳ��������COŨ���������ת���ʣ�
����ƽ����Ҫ������У���Ӧ�Ƿ��ȷ�Ӧ���Խ����¶ȣ���Ӧǰ�����������С����������ѹǿ��Ҳ��������COŨ���������ת���ʣ�
���Դ��ǣ��÷�Ӧ�ġ�S��0��ֻ�е���H��0ʱ������˹�����ܡ�G=��H��T��S���п���С��0����Ӧ������һ���������Է����У�����a��0�����£���ѹ������CO��Ũ�ȣ�
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��״̬���жϵ����⣬�˽�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵������ȷ���ǣ�������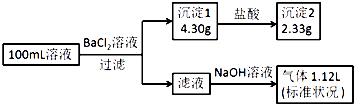
A.ԭ��Һһ������CO32����SO42�� �� һ��������Fe3+
B.ԭ��Һһ������Cl�� �� ���ܴ���Na+
C.ԭ��Һ��c��Cl������0.1molL��1
D.��ԭ��Һ�в�����Na+ �� ��c��Cl������0.1molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴Ӧ��mA������+nB������pC���������ʱ�Ϊ��H�������¶�T��ʱ��t��������C������ٷ���C%��ƽ���������ƽ����Է�������M�Ĺ�ϵ��ͼ1��2��ʾ�����н�����ȷ���ǣ� �� 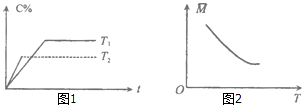
A.m+n��p����H��0
B.m+n��p����H��0
C.m+n��p����H��0
D.m+n��p����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴Ӧ��mA������+nB������pC���������ʱ�Ϊ��H�������¶�T��ʱ��t��������C������ٷ���C%��ƽ���������ƽ����Է�������M�Ĺ�ϵ��ͼ1��2��ʾ�����н�����ȷ���ǣ� �� 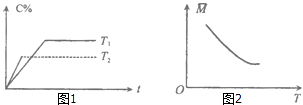
A.m+n��p����H��0
B.m+n��p����H��0
C.m+n��p����H��0
D.m+n��p����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Ԫ�����ڱ�ǰ20��Ԫ�أ���X��ԭ��������Y��4��
��1����X��������Ȼ��ﶼ��ʵ���ҳ��õĸ������
��i������XԪ�ص�һ������Һ��Y��һ����̬��������ǹ�ũҵ�����г�����Ư����������ʵ����Ķ�����ˮ��Һ�з�����Ӧ�Ļ�ѧ����ʽΪ
��ii�����������ı��ʩ��X��һ����̬������������뵪��ͬʱʩ�ã�ԭ��Ϊ
��2����X�ǽ�������ǿ�Ķ�����Ԫ��
��i������X�Ż𣬿��������
��ii��Y����Ԫ�����γ�һ��Ħ������Ϊ43g/mol�Ĺ��ۻ������֪�������ܵ�ײ�����ɷų����������壬д����Ӧ�Ļ�ѧ����ʽ��
��3����X�����Ӱ뾶�ǵ����������Ӱ뾶��С��
Y���Ԫ���γɵĻ�����ĵ���ʽΪ��Y2��NaOH��Һ��Ӧ�IJ���֮һ��OY2 �� �÷�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1��ij�¶��£���ˮ�е�c��H+��=2.0��10��7mol/L����ʱ��Һ��c��OH����=mol/L�����¶Ȳ��䣬����ϡ����ʹc��H+��=5.0��10��4mol/L������Һ�У���ˮ���������c��H+��=mol/L����ʱ�¶�25�棨����ڡ��������ڡ����ڡ�����
��2��ij�¶��µ�ˮ��Һ�У�C ��H+��=10x mol/L��C ��OH����=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ�����㣺���¶���ˮ�����ӻ�Ϊ �� 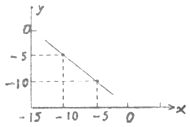
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤��ij����������һ���������Ӽ��������ǣ� ��
A.����ˮ�ܷ�������B.������ˮ
C.����״̬���ܵ���D.���нϸߵ��۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���������ȷ�Ӧ����(����)
A. ��Ƭ��ϡ����ķ�Ӧ B. Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ
C. ���ȵ�̼�������̼�ķ�Ӧ D. �����������е�ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɵ���߷��Ӳ���PPV�ķ�Ӧ��ͼ��ʾ������˵����ȷ���ǣ� �� 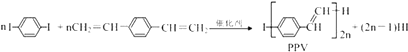
A.PPV�Ǿ۱���Ȳ
B.�÷�ӦΪ���۷�Ӧ
C.PPV��۱���ϩ����С�ṹ��Ԫ�����ͬ
D.1 mol ![]() ������2 mol H2������Ӧ
������2 mol H2������Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com