
| A.①②③ | B.②③④⑤ | C.①②③④ | D.②③④ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.①②③④ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钠(固体) | B.硝酸钾溶液 | C.硫酸钾溶液 | D.硫酸铵(固体) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.反应的化学方程式:2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。| A.逸出ClO2使生成物浓度降低 | B.酸使亚氯酸的氧化性增强 |
| C.溶液中的H+起催化作用 | D.溶液中的Cl-起催化作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| A | 室温(25℃) | 12% | 有 |
| B | 水浴加热(50℃) | 4% | 无 |
| C | 水浴加热( 50℃) | 12% | 有 |
| D | 室温(25℃) | 4% | 无 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g),能使反应速率加快的措施是( )
2CO(g),能使反应速率加快的措施是( )| A.①②③⑥ | B.①②④⑥ |
| C.①②③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100 s | 90 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88 s | 100 s | 120 s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ② | 反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
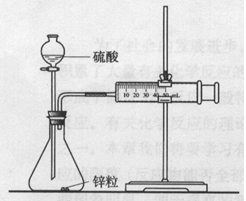
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com