
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHCO3溶液与NaOH反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| D. | 向氢氧化钡溶液中通入少量二氧化硫气体:2OH-+SO2═SO32-+H2O |
分析 A.盐酸为非氧化性酸,铁与稀盐酸反应生成氯化亚铁和氢气;
B.NaHCO3与NaOH溶液反应实质为碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水;
C.氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸;
D.向氢氧化钡溶液中通入少量二氧化硫气体,反应生成亚硫酸钡沉淀和水.
解答 解:A.铁与稀盐酸反应生成氯化亚铁和氢气,反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.NaHCO3溶液与NaOH溶液反应生成可溶性的碳酸钠和水,反应的实质为HCO3-与OH-反应生成CO32-和H2O,该反应的离子方程式为:OH-+HCO3-=CO32-+H2O,故B错误;
C.氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,反应的离子方程式:Cl+H2O=H++Cl-+HClO,故C正确;
D.向氢氧化钡溶液中通入少量二氧化硫气体,离子反应为SO2+Ba2++2OH-=BaSO3↓+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,选项B为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
 已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 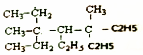 进行一氯取代反应后,能生成6种沸点不同的产物 进行一氯取代反应后,能生成6种沸点不同的产物 | |
| C. | 正戊烷分子中所有的碳原子均在一条直线上 | |
| D. | 分子式为C3H6、C6H12的两种有机物一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Br-、Cu2+ | D. | Ca2+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:实验题
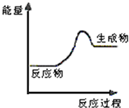 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
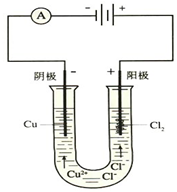 图为电解氯化铜溶液的装置
图为电解氯化铜溶液的装置 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com