
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
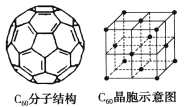
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
【答案】![]() 第四周期 Ⅷ N K sp2 N2O4 2Fe3++2I-=2Fe2++I2 30 12
第四周期 Ⅷ N K sp2 N2O4 2Fe3++2I-=2Fe2++I2 30 12 ![]()
【解析】
(1)铁是26号元素,核外电子排布为2、8、14、2,所以Fe元素在周期表中位置为第四周期第VIII族,Fe3+的核外电子排布为2、8、13,其基态价电子排布图为![]() ;
;
(2)一般情况下,元素的非金属性越强,其从第一电离能就越大,在上述两种钾盐中含有的元素有K、Fe、C、N、O、H,非金属性最强的元素的O元素,但由于N原子的最外层电子处于2p轨道的半充满状态,比较稳定,失去电子比相邻的O元素难,所以两种钾盐中第一电离能最大的元素为N元素;金属性最强的元素的K,故电负性最小的元素为K元素;
(3)在H2C2O4分子中,两个碳原子与O原子形成了碳氧双键,两个碳原子形成了碳碳双键,还与羟基氧原子形成了碳氧单键,所以C的杂化类型是sp2杂化;根据等电子体的概念及C2O42-的构成原子个数、含有的电子数,可知与C2O42-互为等电子体的分子的化学式为N2O4;
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是Fe3+具有强氧化性,I-具有还原性,二者会发生反应:2Fe3++2I-= 2Fe2++I2,所以F-常用于Fe3+的掩蔽剂,而I-不可以;
(5) ①每个碳原子形成1个π键,每π键为2个碳原子共有,则一个C60分子中含有π键个数为(1×60)÷2=30;
②根据晶胞结构示意图可知:C60分子处于晶胞顶点、面心位置,以C60顶点为研究,与之最近的C60分子处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用,与每个C60分子距离最近且相等的C60分子有![]() =12个;
=12个;
③晶胞中C60分子数目=8×![]() +6×
+6×![]() =4,晶胞质量m=
=4,晶胞质量m=![]() g,则晶胞的密度
g,则晶胞的密度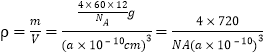 g/cm3。
g/cm3。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,浓度均为 0.1 mol·L-1 的盐酸和醋酸,下列说法正确的是
A. 两种溶液的 pH:盐酸大于醋酸
B. 用相同浓度的 NaOH 溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的 NaOH溶液体积多
C. 向醋酸中加入等物质的量的 NaOH,溶液呈碱性,且溶液中 ![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3B.Ba(NO3)2C.Na2SO4D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水形成VL溶液,其溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 用上图所示方法可保护钢闸门不被腐蚀
B. SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0
C. 常温下,NH4Cl溶液加水稀释,![]() 增大
增大
D. C(s)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是 ( )。

A. a为CH4,b为CO2
B. ![]() 向负极移动
向负极移动
C. 此电池在常温时也能工作
D. 正极电极反应式为O2+2CO2+4e-===2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,4.48 L的NH3气体物质的量为________mol质量为________g,其中含________个氢原子(用NA表示),将其溶于水配成200 mL的溶液,其物质的量浓度为________mol/L,若将标准状况下,4.48 L的NH3气体与0.3 mol的CH4混合,相同条件下,该混合气体对H2的相对密度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在KCl和CaCl2 所组成的某混合物中,K+ 与Ca2+ 的物质的量之比为1∶2,则该混合物中含CaCl2的质量分数为 _______,含1molCl- 的该混合物的质量是____________g。
(2)在标准状况下,由CO 和CO2 组成的混合气体13.44L,质量为20g,该混合气体中,碳与氧两种原子的数目之比为 ____________________。
(3)在某未知体积的NaOH溶液中,经测定含有6.02×1023个OH—,则OH—的物质的量为_______,此溶液中溶质的质量为_______.。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com