
甲醇是一种新型的能源。(8分。每空2分)
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
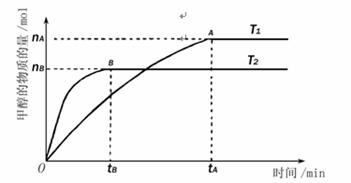
下列说法正确的是 (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=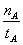 (mol·L-1·min-1)
(mol·L-1·min-1)
B.该反应在T1时C(CH3OH)与C2(H2)*C(CO)的比值比T2时C(CH3OH)与C2(H2)*C(CO)的比值大
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时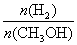 减小
减小
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为 ;
科目:高中化学 来源: 题型:
某高聚物的结构如图: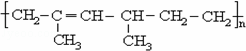 其单体的名称为( )
其单体的名称为( )
A.2,4﹣二甲基﹣2﹣已烯
B.2﹣甲基﹣1,3﹣戊二烯和乙烯
C.2﹣甲基﹣1,3﹣丁二烯和丙烯
D.2,4﹣二甲基﹣1,3﹣已二烯和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
对于mA(s) + nB(g)  eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
 A.达到平衡后,加入催化剂,则C%增大
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡逆向移动
C.化学方程式中n<e +f
D.达到平衡后,增加A的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓 度比为5:4:4
度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
10℃时,某化学反应A→C的反应速率vA=0.1mol·L-1·S-1,若温度每升高10℃,反应速率增加到原来的2倍,若要使vA=1.6 mol·L-1·S-1,则反应温度应控制在( )
A.30℃ B.40℃ C.50℃ D.60℃
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种有机物的结构简式如右:
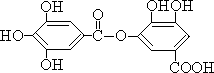 下列有关它的性质的叙述,正确的是( )
下列有关它的性质的叙述,正确的是( )
①它有弱酸性,能与氢氧化钠反应
②它不能发生水解反应
③它能发生水解反应,水解后生成两种物质
④它能发生水解反应,水解后只生成一种物质
A. 只有① B. 只有①② C. 只有①③ D. 只有①④
查看答案和解析>>
科目:高中化学 来源: 题型:
两瓶不同浓度的氢氧化钠溶液各取100ml,分别通入CO2 2.24L(标准状况)。完全反应后,将溶液低温缓慢蒸干,分别得到不含结晶水的固体10.0g、11.6g,判断这两种固体的组成成分,并计算原两瓶氢氧化钠溶液的物质的量浓度各是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH═CHR2,被氧化为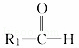 和
和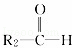 ;
;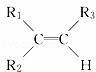 被氧化为
被氧化为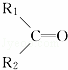 和
和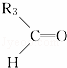 ,由此推断分子式为C4H8的烯烃的氧化产物有( )
,由此推断分子式为C4H8的烯烃的氧化产物有( )
|
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com