
| A. | H2O ( g )═H2 ( g )+$\frac{1}{2}$O2 ( g )△H=+242 kJ/mol | |
| B. | 2H2 ( g )+O2( g )═2H2O ( l )△H=-484 kJ/mol | |
| C. | H2 ( g )+$\frac{1}{2}$O2 ( g )═H2O (g )△H=+242 kJ/mol | |
| D. | 2H2 ( g )+O2 ( g )═2H2O ( g )△H=+484 kJ/mol |
分析 2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,逆过程就要吸收这些热量,据此回答.
解答 解:2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,H2 ( g )+$\frac{1}{2}$O2 ( g )=H2O ( g )△H=-242 kJ/mol,2H2 ( g )+O2 ( g )=2H2O ( g )△H=-484kJ/mol,故CD错误,逆过程就要吸收这些热量,有:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1,故A正确,B错误;
故选A.
点评 本题主要考查学生热化学方程式的书写原则,该题型是现在高考的热点.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: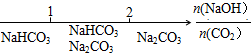 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | NaAl02 | C. | Mgcl2 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:| 实验 序号 | 起始温度 平均值t1 | 终止温度 t2 |
| 1 | 20℃ | 23.2℃ |
| 2 | 20℃ | 23.4℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 只有①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL溶液中一定只有0.02molK+ | B. | 溶液中CO${\;}_{3}^{2-}$浓度为0.1mol/L | ||
| C. | 不能确定Cl-是否存在 | D. | Ba2+和Mg2+一定不存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com