
分析 (1)结合m=nM、n=CV及物质构成计算;
(2)质量分数为28%的KOH水溶液中,设溶液为100g,结合n=$\frac{m}{M}$计算.
解答 解:(1)在200mL2mol/LMgCl2溶液中,溶质的质量为0.2L×2mol/L×95g/mol=38g.此溶液中Mg2+的物质的量浓度为2mol/L,Cl-的物质的量浓度为2mol/L×2=4mol/L,
故答案为:38g;2mol/L;4mol/L;
(2)质量分数为28%的KOH水溶液中,设溶液为100g,则OH-与H2O数目之比是$\frac{100g×28%}{56g/mol}$:$\frac{100g×(1-28%)}{18g/mol}$=1:8,
故答案为:1:8.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
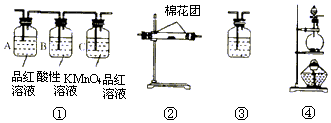 (1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系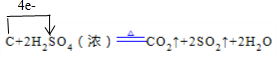 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
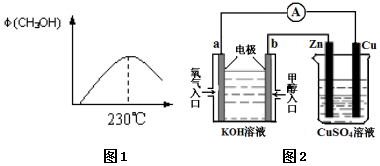 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体分解越完全,消耗盐酸的量越少 | |
| B. | 共生成0.1mol二氧化碳,固体中氯化钠为5.85g | |
| C. | 固体中碳酸氢钠含量越多,钠元素的含量也越多 | |
| D. | 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化反应 | B. | 取代反应 | C. | 加成反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
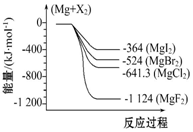 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com