
Ⅰ.甲图是几种实验中常用的仪器:

写出序号所代表的仪器的名称:
A___________;B___________;
C___________;D___________。
Ⅱ.实验室要配制450 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有______________(填选项的字母)。
A.烧杯 B.500 mL容量瓶
C.胶头滴管 D.漏斗 E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是__________。
A.溶液的浓度 B.溶液中NaOH的物质的量
C.溶液的密度 D.溶液中OH-的数目
(4)在配制上述溶液的过程中,下列情况对 NaOH溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”
①转移溶液后烧杯玻璃棒未进行洗涤就进行定容_____________________
②氢氧化钠在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容__________________
③在容量瓶中定容时仰视容量瓶刻度线__________________
④容量瓶洗涤后未干燥即用来配制溶液__________________
科目:高中化学 来源:2015-2016学年河北省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列化学反应,能用离子方程式CO32-+2H+=CO2↑+H2O来表示的是
A.稀硝酸和碳酸钡的反应
B.稀硝酸和碳酸钾溶液的反应
C.石灰石和盐酸的反应
D.盐酸和NaHCO3溶液的反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期中文科化学试卷(解析版) 题型:填空题
①碱金属元素原子最外层电子数都是_________个,在化学反应中它们容易失去_______个电子,碱金属元素原子半径最小的元素是_____________(填元素符号)。
②卤素原子最外层的电子数都是______________,在化学反应中它们容易得到___________个电子,在卤族元素中非金属性最强的是_______________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期中文科化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.铜粉加入稀硝酸中:Cu+2H+= Cu2++H2↑
B.钠投入水中:Na+H2O =Na++2OH一+H2↑
C.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化铝与稀硫酸反应:OHˉ+ H+=H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期中文科化学试卷(解析版) 题型:选择题
日常生活中常用的净水剂-----明矾,明矾[KAl(SO4)2·12H2O]属于
A.酸 B.盐 C.碱 D.氧化物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期中测试化学试卷(解析版) 题型:选择题
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为
A.3∶1 B .1∶1 C.2∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期中测试化学试卷(解析版) 题型:选择题
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、蒸馏、萃取 B.萃取、蒸馏、分液
C.分液、萃取、蒸馏 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源:2016届福建省莆田市高三上学期期中测试化学试卷(解析版) 题型:选择题
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是

A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期第一次联考化学试卷(解析版) 题型:填空题
Ⅰ以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
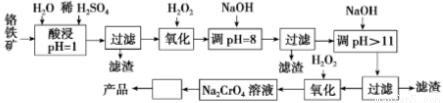
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO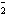 形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | 7.6 | 9.0 | —— | —— |
沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(1)写出流程中第2次使用H2O2时,发生反应的离子方程式 。
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么? 。
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是 。
(4)CrO42-在酸性条件下转化为Cr2O72-。工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为 ,再调节溶液的pH= ,使金属离子生成沉淀而除去。
Ⅱ(4分)(1)已知:20°C时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3•H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂.可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com