
| A. | Fe(OH)2 | B. | A l(OH)3 | C. | Fe(OH)3 | D. | Al(OH)3 和Fe(OH)3 |
分析 将少量铁、铝合金投入到稀盐酸中,完全溶解后,再加入过量的氢氧化钠溶液,亚铁离子转化成氢氧化亚铁沉淀,最终生成氢氧化铁,而铝离子与过量的氢氧化钠反应生成偏铝酸钠,所以过滤后得到的沉淀只有氢氧化铁,由此分析解答.
解答 解:将少量铁、铝合金投入到稀盐酸中,完全溶解后,再加入过量的氢氧化钠溶液,亚铁离子转化成Fe(OH)2,最终生成Fe(OH)3,而铝离子与过量的氢氧化钠反应生成偏铝酸钠,所以过滤后得到的沉淀只有Fe(OH)3,故选C.
点评 本题考查了铁、铝的重要化合物,题目难度不大,明确氢氧化铝的性质为解答关键,注意熟练掌握常见金属及其化合物性质,试题侧重基础知识的考查,有利于培养学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
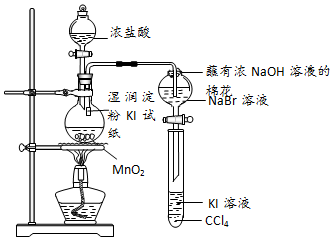
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
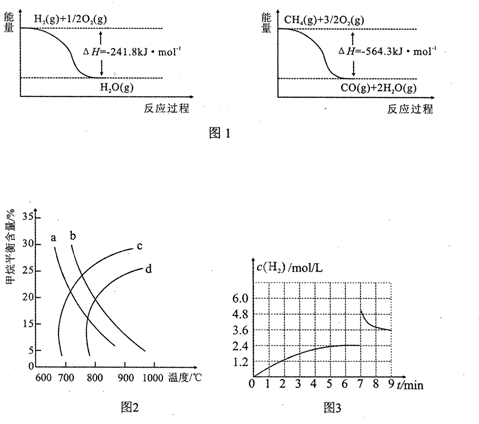
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2P2(g)═P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时,P2比P4具有的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、NO3-、Cl- | B. | Mg2+、NH4+、SO42-、NO3- | ||
| C. | H+、K+、Cl-、CH3COO- | D. | K+、Mg2+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 投料比[n(NO2)/n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
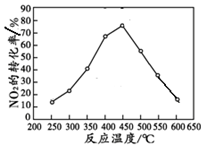
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则含0.5 mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| C. | 可燃物的系数为1的燃烧反应的焓变即为该可燃物的燃烧热 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H=a kJ/mol,2C(s)+O2(g)═2CO(g)△H=b kJ/mol,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻和丝分别属于纤维素、酯类和蛋白质 | |
| B. | 不锈钢餐具属于合金 | |
| C. | 在豆浆中加糖后碗底发现少量晶体状颗粒,这是蛋白质的盐析 | |
| D. | 水的硬度越大,用肥皂洗衣服时效果越好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com