
【题目】实验室在500℃时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )

A. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
C. 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
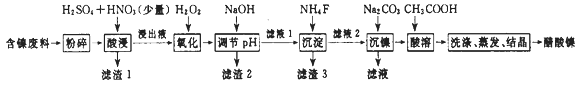
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.0×10-5 |
(1)将含镍废料粉碎的目的是_______________________________________________。
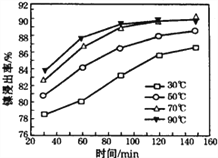
(2)“酸浸”实验中,镍的浸出率结果如图所示,从能量损耗和成本角度考虑,若要使镍的浸出效果最佳,选择的最好温度和时间分别为______℃、______ min。
(3)实验过程中,滤渣1主要成分的化学式为________、________。
(4)调节pH步骤中,溶液pH的调节范围是_____~______。选择此范围的目的是__________________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:______________________________。
(6)沉镍过程中,若c(Ni2+)=4.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为_____g。(保留小数点后1位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )

A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:3:2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 molL﹣1的H2SO4溶液反应,放出11.46 kJ的热量,下列热化学方程式正确的是
A. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
B. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =-11.46 kJmol﹣1
C. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =+114.6 kJmol﹣1
D. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
A. 硫钠电池放电时负极反应为:Na-e-=Na+
B. 硫钠电池充电时,每生成1molNa转移xmol电子
C. 铂电极b为电解池阴极,电极反应式为N2+6e-+6H+=2NH3
D. 合成氨过程中H+经质子交换膜由a极向b极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数随pH变化的关系如图所示.下列表述正确的是( )
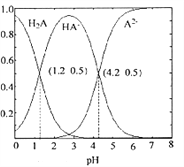
A. 在含H2A、HA-、A2-的溶液中,通入少量HCl,HA-的物质的量分数一定变大
B. 将等物质的量的NaHA、Na2A溶于水中,所得溶液中存在:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
C. 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国决定2011年为国际化学年,旨在纪念化学学科取得的成就及对人类的巨大贡献。下列科学家取得的成就与化学学科研究领域无关的是( )
A.哈伯发明合成氨技术B.门捷列夫发现元素周期律
C.爱因斯坦提出相对论D.居里夫人发现镭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为海水吸收CO2并进行碳循环的原理示意图。下列说法错误的是

A. “光合”作用中太阳能转化为化学能
B. 钙化中释放CO2的反应为:2 NaHCO3+CaCl2==CaCO3↓+CO2↑+2NaCl+H2O
C. 吸收的CO2与钙化中释放的CO2的量相等
D. 此碳循环中将CO2转化为无机物和有机物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com