
| m |
| M |
| m |
| V |
| n |
| V |
| 32g |
| 64g/mol |
| 32g |
| 11.2L |
| 0.5mol |
| 0.8L |
| M |
| Vm |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
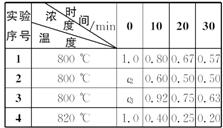
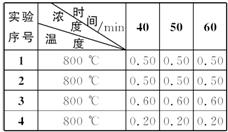
根据上述数据,完成下列填空。
(1)实验1,反应在10—20 min时间内A的平均反应速率为__________mol·(L·min)-1。
(2)实验2,A的初始浓度c2=__________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是________________。
(3)设实验3的反应速率为 v3,实验1的反应速率为v1,则v3__________v1(填“>”“=”“<”),且c3__________1.0 mol·L-1(填“>”“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是__________(填“吸热”“放热”)反应。理由是___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届四川省资阳市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA
B.在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+
C.在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2 NA个NH3分子
D.标准状况下,11.2 L四氯化碳中含有的C—Cl键的个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com