
【题目】25℃时,取0.lmolL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3B. NH4AC. NH4HSO4D. NH4Cl
【答案】A-+H2OHA+OH- > c(Na+)>c(A-)>c(OH-)>c(H+) 0.05 > A>B>D>C
【解析】
0.lmol/LHA溶液与0.1mol/LNaOH溶液等体积混合,反应恰好生成NaA,混合溶液的pH=8,溶液为碱性,说明A-水解使溶液呈碱性,据此分析解答(1)~(4);
(5)NH4A溶液为中性,说明NH4+和A-的水解程度相当,将HA溶液加到Na2CO3溶液中有气体放出,说明酸性HA强于H2CO3,据此分析解答;
(6)NH4HSO4中电离出H+,酸性最强,NH4Cl为强酸弱碱盐,水解显酸性,NH4A为中性,酸性强弱HA>H2CO3,据此分析解答。
(1)0.lmol/LHA溶液与0.1mol/LNaOH溶液等体积混合,反应恰好生成NaA,混合溶液的pH=8,溶液为碱性,说明A-水解,A-+H2OHA+OH-,故答案为:A-+H2OHA+OH-;
(2)NaOH抑制水的电离,NaA水解促进水的电离,所以混合溶液中由水电离出的c(OH-)>0.1mol/LNaOH 溶液中由水电离出的c(OH-),故答案为:>;
(3)溶液呈碱性,则溶液中c(OH-)>c(H+),A-水解,所以溶液中离子浓度大小顺序为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(4)反应恰好生成NaA,混合液中存在物料守恒:c(HA)+c(A-)= c(Na+)=![]() =0.05mol/L,故答案为:0.05;
=0.05mol/L,故答案为:0.05;
(5)NH4A溶液为中性,说明NH4+和A-的水解程度相当,将HA溶液加到Na2CO3溶液中有气体放出,说明酸性HA强于H2CO3,则CO32-水解程度大于A-,因此CO32-水解程度大于NH4+,所以(NH4)2CO3溶液呈碱性,pH>7,故答案为:>;
(6)阴离子水解使溶液呈碱性,阳离子水解使溶液呈酸性,阳离子相同,比较阴离子水解程度,NH4HSO4中电离出H+,酸性最强,pH最小,酸性强弱HCl>HA>H2CO3,其中Cl-不水解,NH4Cl显酸性,水解程度A-<HCO3-,NH4A为中性,则NH4HCO3显碱性,因此pH由大到小的顺序为:A>B>D>C,故答案为:A>B>D>C。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO![]() )>c(NH
)>c(NH![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.在 0.1 mol·L-1Na2CO3 溶液中:c(OH-)=c(HCO![]() )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
C.向Na2C2O4溶液中滴加HCl溶液至pH=7,所得溶液中: c(Cl-)=c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
D.pH=12 NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是

A.分子中含有两种官能团
B.该物质中的碳原子一定全部共面
C.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D.香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中性、室温下,催化剂FeQ或FeCuQ催化![]() 解离产生的
解离产生的![]() 来降解浓度为
来降解浓度为![]() 的苯酚,降解率
的苯酚,降解率 随
随![]() 浓度、反应时间的关系如图所示
浓度、反应时间的关系如图所示![]() 保持其他条件相同
保持其他条件相同![]() 。
。
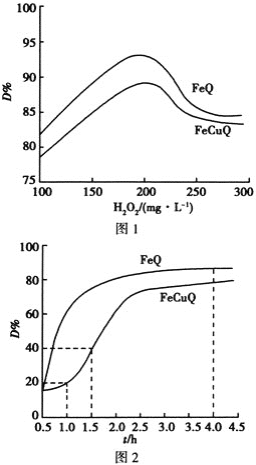
下列说法不正确的是 ![]()
![]()
A.在FeCuQ催化下,![]() 内,苯酚降解速率为
内,苯酚降解速率为![]() mol/(L·h)
mol/(L·h)
B.其他条件不变时,随![]() 浓度的增大,降解率
浓度的增大,降解率![]() 不一定增大
不一定增大
C.FeQ催化![]() 后,降解率
后,降解率![]() 不变,可能是反应达到了平衡状态
不变,可能是反应达到了平衡状态
D.随![]() 浓度的增大降解率
浓度的增大降解率![]() 减小的原因可能是过量
减小的原因可能是过量![]() 导致
导致![]() 浓度减小
浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常稳下,某绝热容器中盛有50mLc(H+)=10-3mol·L-1的HX溶液,向该容器中滴加c(OH-)=10-2mol·L-1的NaOH溶液,滴加过程中混合溶波的温度(T)与所加溶液体积(V)的关系如图所示。下列叙述不正确的是
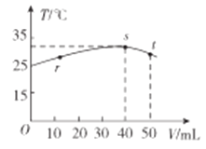
A.s点时:c(Na+)>c(X-)>c(OH-)>c(H+)
B.r→s的过程中,混合溶液中可能存在c(X-)=c(Na+)
C.pH=10的NaX溶液,用蒸馏水稀释10倍后,溶液的pH>9
D.已知某温度下CaX2的Ksp=5.3×10-9mol·L-3,在该温度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高浓度是5.3×10-8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定![]() 溶液先升温再降温过程中的pH,数据如下。实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验。④产生白色沉淀多。下列说法不正确的是
溶液先升温再降温过程中的pH,数据如下。实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验。④产生白色沉淀多。下列说法不正确的是![]()
![]()
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
pH |
|
|
| 9.25 |
A.![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B.④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的![]() 值相等
值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的一种质量数为14的原子常用来测定文物的年代;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d64s2。
(1)A、B、C、D四种元素中,电负性最大的是_______________(填元素符号)。
(2)等电子体具有相似的结构和性质。AC与B2、AC2与CAB-均互为等电子体,则AC的电子式为_________。CAB-中A原子的杂化方式为_________。,E能与AC分子形成E(AC)5,其原因是AC分子中含有______________________。
(3)最近发现,只含A、D、E三种元素的一种晶体(晶胞如图所示)具有超导性。A原子的配位数为___________;该晶体的化学式为___________。

(4)已知C、E形成的一种晶体ExC,晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知该晶体密度为ρ=3.53g/cm3,晶胞边长为5.0×10-10m。则该晶体中x值(精确至0.1)为_______。晶体中的Fen+分别为Fe2+、Fe3+,则Fe2+与Fe3+的比值为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com