
分析 A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,据此解答.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,
氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2 AlO2-+H2O,
故答案为:第三周期第ⅢA族;Al2O3+2OH-=2 AlO2-+H2O;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,
故答案为:CH3OH;
(3)A2W2为H2O2,是二元弱酸,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:BaO2+H2SO4=BaSO4↓+H2O2;
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入H2O2,观察到溶液呈蓝色并有红褐色沉淀生成,反应生成Fe(OH)3与I2,当消耗2mol I-时,共转移3mol电子,说明被氧化的Fe2+为1mol,参加反应的H2O2为1.5mol,该反应的离子方程式是:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2,
故答案为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2;
(5)NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56.
点评 本题考查元素的推断和元素化合物知识,难度中等,本题侧重于常见化合物的存在为突破口,注重于元素化合物的考查,做题时注意把握题给信息.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
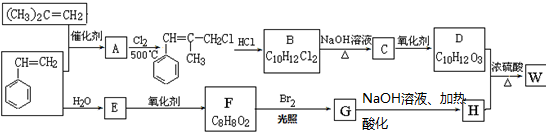 ,
,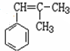 ; F的结构简式为
; F的结构简式为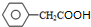 ;
;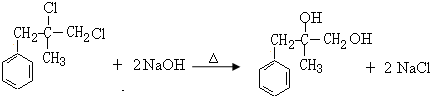 ;D+H→W的化学方程式为
;D+H→W的化学方程式为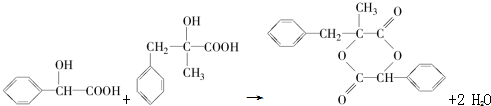 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 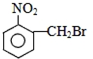 | B. | 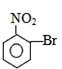 | C. | 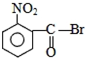 | D. | 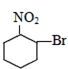 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焦糖烯能使溴水褪色 | |
| B. | “半成品碳”是碳元素的一种新单质 | |
| C. | 蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成 | |
| D. | 焦糖烯是一种新型的烯经 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 加热液体的试管口不能正对着自己或别人 | |
| C. | 浓NaOH溶液洒到皮肤上,用大量水冲洗后,再涂上5%的硼酸溶液 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别其他分散系本质特征是分散质微粒直径在lnm~100nm之间 | |
| B. | Fe(OH)3胶体能够使水中的悬浮的固体颗粒沉降,达到净水目的 | |
| C. | 用滤纸可分离溶液和胶体 | |
| D. | 光线通过胶体时会产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 1 mol•L-1AlCl3溶液 | ||
| C. | 75 mL 2 mol•L-1CaCl2溶液 | D. | 200 mL 2 mol•L-1 KCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com