
| A. | 为消除碘缺乏症,我国卫生部门规定食盐中必须加碘,其中碘元素以KI形式存在 | |
| B. | 空气污染日报中的空气污染指数的主要项目有可吸入颗粒物、二氧化硫、二氧化氮和二氧化碳 | |
| C. | 用含橙色的酸性重铬酸钾溶液的仪器检验酒驾,利用了乙醇的挥发性和还原性 | |
| D. | 为了获得更好的消毒效果,医用酒精的浓度通常为95% |
分析 A.碘盐是在食盐中加入一定量的碘酸钾;
B.二氧化碳不是空气污染的主要物质;
C.乙醇的沸点低,易挥发,能与酸性重铬酸钾反应;
D.医用酒精的浓度为75%.
解答 解:A.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,在食盐中所加含碘物质是碘酸钾(KIO3),故A错误;
B.可吸入颗粒物、二氧化硫、二氧化氮为污染环境的主要物质,为空气污染日报中的空气污染指数,其中没有二氧化碳这一项,故B错误;
C.乙醇的沸点低,易挥发,能与酸性重铬酸钾反应,反应中乙醇作还原剂,表现还原性,所以用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性,故C正确;
D.医用酒精的浓度为75%,不是95%,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})•c({H}^{+})}$增大 | |
| B. | 通入CO2,或者加入少量氯化铵溶液,溶液pH均减小 | |
| C. | 升高温度,红色变深,平衡常数增大 | |
| D. | 加入NaOH固体,$\frac{c(HCO_3^-)}{{c(CO_3^{2-})}}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
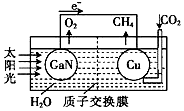 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 | |
| B. | Cu电极上的电极反应为CO2+8e-+8H+=CH4+2H2O | |
| C. | H+从左池移向右池 | |
| D. | 当装置中有1mol CH4生成时,GaN电极有44.8LO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | “酸坏之酒皆可蒸烧,复烧二次价值数倍也”.该方法也可以分离乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
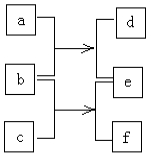 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )| A. | 原子半径:Z>Y>X>W | |
| B. | Y与Z形成的两种常见化合物中阴阳离子个数比均为1:2 | |
| C. | b与c反应比b与a反应剧烈 | |
| D. | 元素W、Y形成的化合物的沸点一定比W、X形成的化合物高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是具有刺激性的红棕色气体 | |
| B. | SO3溶于水生成亚硫酸 | |
| C. | 向品红溶液中通入二氧化硫气体,溶液褪色,加热后溶液又会出现红色 | |
| D. | 氨水中滴入酚酞溶液,颜色变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
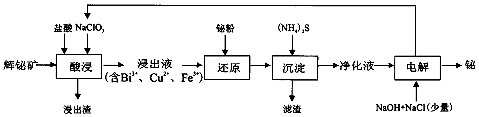
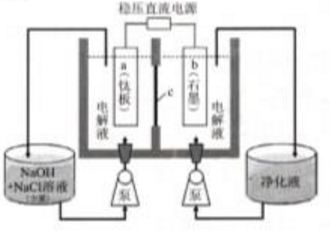
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③均能发生加成反应 | B. | ②④互为同系物 | ||
| C. | ①②③④均属于烃 | D. | ①②④的一氯代物均只有两种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com