
【题目】在2L的密闭容器中进行反应:3H2(g) + N2(g)![]() 2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 sB. 20 sC. 30 sD. 40 s
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】砷![]() 及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中,回答下列问题:
及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中,回答下列问题:
(1)砷是第四周期ⅤA族元素。下列关于第ⅤA族元素及其化合物的说法不正确的是______(填序号)。
a.沸点:![]() b.酸性:
b.酸性:![]()
c.![]() 的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的![]() ;
;
②![]() 与
与![]() 溶液反应产生
溶液反应产生![]() 与另一种固体,该反应的离子方程式为____。
与另一种固体,该反应的离子方程式为____。
(3)砷酸![]() 可用于制造杀虫剂、药物。
可用于制造杀虫剂、药物。![]() 溶于稀硝酸中可得砷酸,此反应的化学方程式为________。
溶于稀硝酸中可得砷酸,此反应的化学方程式为________。
(4)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[![]() 和
和![]() ],吸附沉降砷的化合物。在其它条件一定时,调节水样的
],吸附沉降砷的化合物。在其它条件一定时,调节水样的![]() ,得到除砷效率曲线如图所示。
,得到除砷效率曲线如图所示。
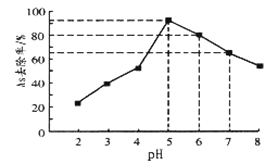
①请解释水样酸性较强时,除砷效率较低的原因是______________。
②国家饮用水标准规定水中砷的含量应低于![]() 。某水样中含砷总浓度为
。某水样中含砷总浓度为![]() ,若控制水样的
,若控制水样的![]() ,出水后的砷浓度______(填“能”或“否”)达到饮用水标准。
,出水后的砷浓度______(填“能”或“否”)达到饮用水标准。
(5)反应![]()
![]() 。在容积为
。在容积为![]() 的密闭容器中进行。起始时
的密闭容器中进行。起始时![]() 和
和![]() 均为
均为![]() 。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
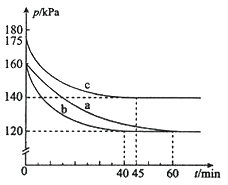
①实验a从反应开始至达到平衡时的反应速率![]() ______(保留两位有效数字)。
______(保留两位有效数字)。
②与实验a相比,其他两组改变的实验条件是:b______、c________。
③用![]() 表示开始时总压强,
表示开始时总压强,![]() 表示平衡时总压强,
表示平衡时总压强,![]() 表示
表示![]() 的平衡转化率,则
的平衡转化率,则![]() 的表达式为____。
的表达式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:
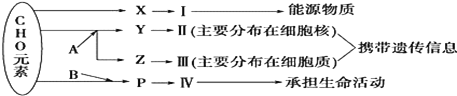
(1)图中X是________;Ⅰ在小麦种子中主要是指__________。
(2)在病毒中,携带遗传信息的物质是________________(填序号)。
(3)图中A、B分别代表何种元素?A:______,B:______。
(4)导致地球上生物多种多样的直接原因是[ ] _________(填序号和名称)结构的多样性。
(5)物质Ⅱ在人体细胞中的主要载体是________,该分子中______________决定了物质Ⅱ的多样性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某可逆反应在某体积为2L的密闭容器中进行,在从0~3min各物质的量的变化情况如图所示(A、B、C均为气体)。

(1)该反应的化学方程式为______。
(2)反应开始至2min时,B的平均反应速率为______。
(3)能说明该反应已达到平衡状态的是______。
A. c(A)= c(B)= c(C) B.容器内压强保持不变
C .v逆(A)= v正(C) D. c(C)不再变化
(4)由图求得A的平衡时的转化率为______。
Ⅱ.(5)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol-1 | a | b | c |
则合成氨反应:N2(g) + 3H2 (g)= 2NH3(g) ![]() H = ______kJ·mol-1
H = ______kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中每一个方格表示有关的一种反应物或生成物(部分的产物已省略);X加热产生等物质的量的A、B、C三种物质,常温下A、C为无色气体,B是一种无色无味的液体;X与NaOH溶液在加热作用下产生一种能使湿润的红色石蕊试纸变蓝的气体C;X与HCl反应产生一种无色无味的气体A,它能使澄清石灰变浑浊。请填下列空白:

(1)物质X是______,B是_______(以上均填写化学式)
(2)A的电子式为______C的结构式为___
(3)X加热分解的化学方程式___
(4)反应①的化学方程式___
(5)F→G的化学方程式___
(6)G→E的离子方程式___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
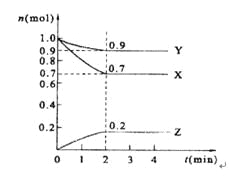
(1)X的转化率是______;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________;
(4)当反应进行到第____min,该反应是达到平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. 先a通入CO2,然后b通入NH3,c中放碱石灰
B. 先b通入NH3,然后a通入CO2,c中放碱石灰
C. 先a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. 先b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是

A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是七个基本____________之一,用来表示____________________的集合,符号是___________,单位符号是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com