
 ;
;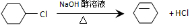
 .
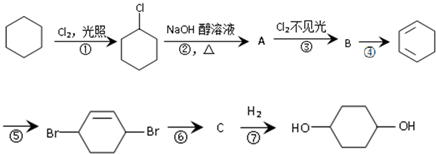
. 分析 环己烷和氯气发生取代反应生成 ,
, 在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为:
在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为: ,A和氯气反应生成B,B发生消去反应生成
,A和氯气反应生成B,B发生消去反应生成 ,所以B为
,所以B为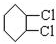 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成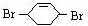 ,
,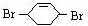 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,
, 与氢气发生加成反应生成
与氢气发生加成反应生成 .
.
解答 解:环己烷和氯气发生取代反应生成 ,
, 在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为:
在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为: ,A和氯气反应生成B,B发生消去反应生成
,A和氯气反应生成B,B发生消去反应生成 ,所以B为
,所以B为 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成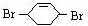 ,
,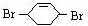 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,
, 与氢气发生加成反应生成
与氢气发生加成反应生成 .
.
(1)由上述分析可知,反应①⑥属于取代反应,反应②④属于消去反应,反应③⑤⑦属于加成反应,
故答案为:①⑥;②④;③⑤⑦;
(2)C的结构简式为 ,故答案为:
,故答案为: ;
;
(3)反应②方程式为: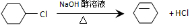 ,反应⑤反应方程式为
,反应⑤反应方程式为 ,
,
故答案为: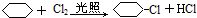 ;
; .
.
点评 本题考查有机物的合成,根据有机物的结构进行推断,熟练掌握官能团的性质与转化,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
 .
.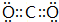 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼的非金属元素 | |
| C. | 若Y的最低化合价是-2,则Z的最高正价为+6 | |
| D. | 若X的最高正价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
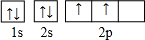
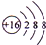
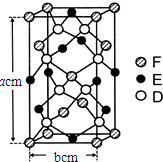 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-N+2m)mol | B. | $\frac{a}{A+m}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N+2m)mol | D. | $\frac{a}{A+2m}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO均难溶于水 | |
| B. | CO、NO均为酸性氧化物 | |
| C. | CO、NO均为无色无味的有毒气体 | |
| D. | 在催化剂的作用下,可通过反应2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2来达到净化汽车尾气的目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com