
【题目】乙酰苯胺是一种具有退热镇痛作用的药物,可用苯胺和冰醋酸为原料来制备乙酰苯胺。
①化学原理为: (已知:苯胺易被氧化)
(已知:苯胺易被氧化)
②相关物质的物理常数
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | |||||
苯胺 | 93 | 无色液体 | 6 | 184 | 3.42(20℃) | 任意比混溶 |
冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 白色片状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃)、5.20(100℃) | 36.9(20℃) |
③制各乙酰苯胺的装置如图所示:韦氏分馏柱作用与原理类似于冷凝管。
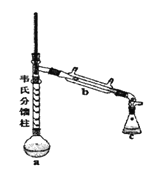
④制备方法和过程:

(1)仪器a的名称_______。
(2)制备过程中加入锌粒的作用:其一是________、其二是防止暴沸。
(3)从化学平衡的角度分析,步骤1要控制分馏柱上端的温度在105℃左右的原因_____。
(4)步骤2
(5)步骤3中洗涤剂最好选择________。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
(7)本实验所得到的乙酰苯胺产率是________。
【答案】圆底烧瓶(或蒸馏烧瓶) 防止苯胺在反应过程中被氧化 不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率 洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促进其析出 A 趁热过滤 40%
【解析】
5.0mL苯胺、7.4mL冰醋酸、0.10g锌粒混合加热至沸腾30min,趁热倒入水中析出晶体,抽滤洗涤干燥得到粗产品,重结晶得到较纯净的产品。
(1)根据仪器a的结构判断其名称;
(2)加入锌粒的目的其一是和酸反应生成氢气,在氢气环境中避免苯胺被氧化,其二是防止暴沸。
(3)由物质的沸点可知,这几种反应物和生成物在105℃的条件下,只能蒸出H2O;
(4)根据不同物质在水中的溶解度的不同及温度对苯胺的溶解度的影响分析;
(5)苯胺在冷水中的溶解度会更小;
(6)避免晶体在过滤过程中有损失,所以要趁热过滤、冷去结晶;
(7)结合化学方程式计算乙酰苯胺的理论产量,进而计算制备过程的产率=![]() ×100%。
×100%。
(1)根据图示可知仪器a的名称是圆底烧瓶;
(2)由于苯胺易被氧化,加入过量的锌,锌和醋酸反应生成氢气,提供氢气环境就可以防治苯胺被氧化;
(3)由物质的沸点可知,这几种反应物和生成物在105℃的条件下,只能蒸出H2O,不断分离出反应过程中生成的水,促进反应正向进行,从而就提高生成物的产率;
(4)步骤2中将反应液倒入冷水中的目的是:因为在水中,相比而言,乙酰苯胺的溶解度较小,而冰醋酸、苯胺相对来说溶解度较大,用冷水可以洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(5)乙酰苯胺在冷水中的溶解度会更小,因此应选择冷水,故合理选项是A;
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→冷却结晶→抽滤→洗涤→干燥,在操作过程中要尽量避免晶体过滤过程中有损失,因此要趁热过滤,然后冷却结晶;
(7)依据化学方程式可知苯胺与醋酸是等物质的量的关系进行的反应,由于醋酸过量,因此反应产生的乙酰苯胺要以不足量的苯胺为标准计算。乙酰苯胺的理论产量为:m(乙酰苯胺)=0.05mol×135g/mol=6.75g因此,上述制备过程的产率是:![]() ×100%=
×100%=![]() ×100%=40%。
×100%=40%。


科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物相对分子质量为17;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)Z元素原子的 L层电子数为______,元素 Y的原子结构示意图___________,T的一种核素在考古时常用来鉴定一些文物的年代,用的核素是___________(填核素符号)。
(2)元素Q与V可以形成18电子化合物的其电子式为_________,元素W与Q形成的化合物的类型_____________(填‘离子化合物’或‘共价化合物’)。
(3)V的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是___________。
(4)写出X、W 两种元素最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________。
(3)B单质在A单质中燃烧,生成物的化学式为___________。
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______,写出有关化学反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
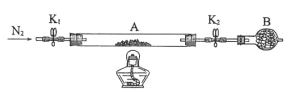
①仪器B的名称是____。
②将下列实验操作步骤正确排序____(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
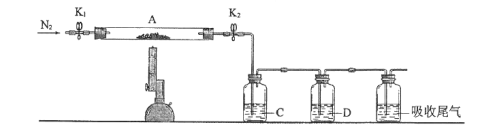
①C、D中的溶液依次为____(填标号)。C、D有气泡,并可观察到的现象分别为____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
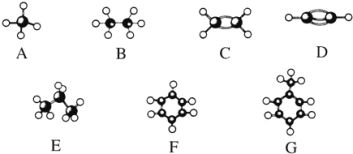
(1)E的一氯取代物同分异构有_______种。
(2)一卤代物种类最多的是________。(请填字母,下同)
(3)能够与Br2发生加成反应的两种气态烃是________。
(4)能够与酸性高锰酸钾反应的烃是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com