
分析 (1)根据反应物、生成物及质量守恒定律写出该反应的化学方程式;
(2)根据题中数据可知,推断NxHy化学式的根据为阿伏伽德罗定律;
(3)由产物知O2过量,反应前后质量守恒,又所有气体在同温同压下测定,根据ρ=$\frac{m}{V}$知,密度与体积成反比,反应后气体体积V=(4+3)mL÷(1-$\frac{3}{10}$)=10mL,利用差量法计算x、y的关系.
解答 解:(1)根据题意可知,反应物为氧气和NxHy,生成为N2、H2O,根据质量守恒可得,该反应的化学方程式为:yO2+4NxHy═2xN2+2yH2O,
故答案为:yO2+4NxHy═2xN2+2yH2O;
(2)恒温恒压下,等体积的气体具有相同的物质的量,即:阿伏伽德罗定律,可以据此确定NxHy的化学式,
故答案为:阿佛加德罗定律推论;
(3)由产物知O2过量,反应前后质量守恒,又所有气体在同温同压下测定,根据ρ=$\frac{m}{V}$知,密度与体积成反比,反应后气体体积V=$\frac{(4+3)moL}{1-0.3}$=10mol,
即:气体在反应后体积增加3mol.由反应的化学方程式:
yO2+4NxHy═2xN2+2yH2O△n
4mol 2x+y-4mol
3mol 3mol
所以:2x+y-4=4,
即:2x+y=8,
故答案为:2x+y=8.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握差量法、质量守恒定律在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 石油裂化的主要目的是为了提高轻质油的质量和产量 | |
| B. | 石油分馏所得到的馏分是一种具有固定熔沸点的纯净物 | |
| C. | 可燃冰、干冰和冰的主要化学成分相同 | |
| D. | 石油的裂化、分馏、裂解等都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
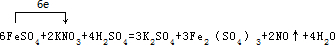 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
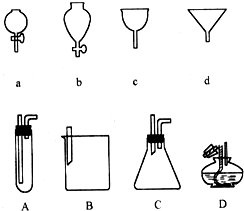 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2L溶液中阴阳离子总数为0.8NA | |
| B. | 500mL溶液中的Ba2+离子浓度为0.2mol•L-1 | |
| C. | 500mL溶液中的NO3-离子总数为0.2NA | |
| D. | 500mL溶液中的NO3-浓度为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com