
ЁОЬтФПЁПЛдЭПѓЪЧвЛжжживЊЕФЭПѓЪЏЃЌжївЊКЌгаСђЛЏбЧЭЃЈCu2SЃЉЃЌЛЙгаFe2O3ЁЂSiO2МАвЛаЉВЛШмаддгжЪЁЃвЛжжвдЛдЭПѓЪЏЮЊдСЯжЦБИЯѕЫсЭОЇЬхЕФЙЄвеСїГЬШчЯТЃК

вбжЊЃКВПЗжН№ЪєбєРызгЩњГЩЧтбѕЛЏЮяГСЕэЕФpHЗЖЮЇШчЯТБэЫљЪОЃЈПЊЪМГСЕэЕФpHАДН№ЪєРызгХЈЖШЮЊ1.0mol/LМЦЫуЃЉ
Рызг | ПЊЪМГСЕэЕФpH | ЭъШЋГСЕэЕФpH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
ЛиД№ЯТСаЮЪЬт
ЃЈ1ЃЉНўШЁКѓЕУЕНЕФНўГівКжаКЌгаCuSO4ЁЂMnSO4ЁЃаДГіНўШЁЪБВњЩњCuSO4ЁЂMnSO4ЗДгІЕФЛЏбЇЗНГЬЪН__________ЁЃ
ЃЈ2ЃЉЕїНкpHЕФФПЕФЪЧ___________ЃЌpHЕФЕїНкЗЖЮЇЮЊ___________ЁЃ
ЃЈ3ЃЉЩњГЩMnCO3ГСЕэЕФРызгЗНГЬЪНЮЊ___________ЁЃ
ЃЈ4ЃЉВйзїAЮЊ___________ЁЃ
ЃЈ5ЃЉгЩЛдЭПѓжЦШЁЭЕФЗДгІЙ§ГЬПЩвдБэЪОЮЊЃК
2Cu2SЃЈsЃЉ+3O2ЃЈgЃЉЈT 2Cu2OЃЈsЃЉ+ 2SO2ЃЈgЃЉЁїH=Љ768.2kJ/mol
2Cu2OЃЈsЃЉ+ Cu2SЃЈsЃЉЈT 6CuЃЈsЃЉ+ SO2ЃЈgЃЉЁїH=" +116.0" kJ/mol
дђгЩCu2SгыO2МгШШЗДгІЩњГЩCuЕФШШЛЏбЇЗНГЬЪНЮЊ___________ЁЃ
ЃЈ6ЃЉШєгУКЌ85% Cu2SЃЈMr=160ЃЉЕФЛдЭПѓРДжЦБИЮоЫЎCuЃЈNO3ЃЉ2ЃЌМйЩшНўШЁТЪЮЊ95%ЃЌЕїНкpHЪБЫ№Cu 3%ЃЌеєАБЙ§ГЬжага5%ЮДзЊЛЏЮЊCuOЃЌЦфЫќЙ§ГЬжаЮоЫ№КФЃЌдђ1.6 kgетбљЕФЛдЭПѓзюЖрФмжЦБИ__________molЮоЫЎCuЃЈNO3ЃЉ2ЁЃ(МЦЫуНсЙћОЋШЗЕНаЁЪ§ЕуКѓ1ЮЛ)
ЁОД№АИЁП2MnO2 + Cu2S + 4H2SO4 ЃНSЁ§+ 2CuSO4 + 2MnSO4 +4H2O ЬњРызгзЊЛЏГЩЧтбѕЛЏЬњЭъШЋГСЕэ 3.2ЁмpHЃМ4.4 Mn2+ + NH3 + HCO3ЉЃНMnCO3Ё§ + NH4+ еєЗЂХЈЫѕЁЂРфШДНсОЇЃЈЙ§ТЫЃЉ Cu2SЃЈsЃЉ+ O2ЃЈgЃЉЃН2CuЃЈsЃЉ+ SO2ЃЈgЃЉЁїHЃНЉ217.4 kJ/mol 14.9
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнЙЄвеСїГЬНўШЁЪБЕФЗДгІЃКCu2S ЃЋ MnO2 ЃЋ H2SO4 Ёњ MnSO4 ЃЋ CuSO4 ЃЋ H2O + SЃЌИљОнЛЏКЯМлЕФЩ§НЕХфЦНЃЌCu2SећЬхЩ§Ип4ЃЌMnO2ЯТНЕ2ЃЌзюаЁЙЋБЖЪ§4ЃЌMnO2КЭMnSO4ЕФЯЕЪ§ЮЊ2ЃЌCu2SЕФЯЕЪ§ЮЊ1ЃЌИљОндзгИіЪ§ЪиКуЃЌХфЦНЦфЫћЃЌCu2SЃЋ2MnO2ЃЋ4H2SO4ЃН2CuSO4ЃЋ2MnSO4ЃЋ2SЁ§ЃЋ4H2OЃЛ
ЃЈ2ЃЉЕїНкpHЕФФПЕФШУЬњдЊЫизЊЛЏГЩFe(OH)3ЃЌГ§ШЅЃЌИљОнЪЕбщФПЕФКЭpHЗЖЮЇЃЌFe(OH)3ШЋВПзЊЛЏГЩГСЕэЃЌЕЋВЛФмЩњГЩCu(OH)2ЃЌвђДЫpHЕФЗЖЮЇгІЪЧ3.2ЁмpHЃМ4.4ЃЛ
ЃЈ3ЃЉИљОнСїГЬЭМMn2ЃЋЃЋHCO3ЃЃЋNH3ЁњMnCO3Ё§ЃЋNH4ЃЋЃЌЛЏКЯМлЮоБфЛЏЃЌХфЦНЕУЃКMn2ЃЋЃЋHCO3ЃЃЋNH3ЃНMnCO3Ё§ЃЋNH4ЃЋЃЛ
ЃЈ4ЃЉCuOЃЋ2HNO3ЃНCu(NO3)2ЃЋH2OДгШмвКжаЕУЕНОЇЬхЃЌВЩгУеєЗЂХЈЫѕЁЂРфШДНсОЇЃЛ
ЃЈ5ЃЉСНЪНЯрМгЃК3Cu2S(s)ЃЋ3O2(g)ЃН6Cu(s)ЃЋ3SO2ЁїHЃН(Ѓ768.2ЃЋ116.0)kJЁЄmolЃ1ЃНЃ652.2kJЁЄmolЃ1ЃЌМДCu2S(s)ЃЋO2(g)ЃН2Cu(s)ЃЋSO2(g) ЁїHЃНЃ217.4kJЁЄmolЃ1ЃЛ
ЃЈ6ЃЉИљОнЭдзгЪиКуПЩжЊn[Cu(NO3)2]ЃН![]() ЃН14.9molЁЃ
ЃН14.9molЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. КуШнУмБеШнЦїжаНјааЕФЗДгІЃКAЃЈsЃЉЃЋ3BЃЈgЃЉ![]() 2CЃЈgЃЉЃЋDЃЈgЃЉЃЌШчЙћЦјЬхУмЖШБЃГжВЛБфЃЌЫЕУїЗДгІвбОДяЕНЦНКт
2CЃЈgЃЉЃЋDЃЈgЃЉЃЌШчЙћЦјЬхУмЖШБЃГжВЛБфЃЌЫЕУїЗДгІвбОДяЕНЦНКт
B. C ( s) + H2O (g) ![]() CO ( g) + H2 (g)ЃЌЦфЫћЬѕМўВЛБфЃЌЫѕаЁШнЦїЬхЛ§ЃЌе§ЫйТЪМѕаЁЃЌФцЫйТЪдіДѓ
CO ( g) + H2 (g)ЃЌЦфЫћЬѕМўВЛБфЃЌЫѕаЁШнЦїЬхЛ§ЃЌе§ЫйТЪМѕаЁЃЌФцЫйТЪдіДѓ
C. N2(g) + 3H2(g)![]() 2NH3(g) ЁїH=ЁЊ93kJЁЄmolЁЊ1ЃЌЭљКуШнУмБеШнЦїжаГфШы0.4 molN2(g)КЭ2 mol H2(g)ДяЕНЦНКтЪБЃЌПЩвдЗХГі37.2 kJЕФШШСП
2NH3(g) ЁїH=ЁЊ93kJЁЄmolЁЊ1ЃЌЭљКуШнУмБеШнЦїжаГфШы0.4 molN2(g)КЭ2 mol H2(g)ДяЕНЦНКтЪБЃЌПЩвдЗХГі37.2 kJЕФШШСП
D. A(g)+ 3B (g) ![]() 2C (g) + D (g)ЃЌдкСНжжВЛЭЌЧщПіЯТЕФЗДгІЫйТЪЗжБ№ЮЊЃКЂй
2C (g) + D (g)ЃЌдкСНжжВЛЭЌЧщПіЯТЕФЗДгІЫйТЪЗжБ№ЮЊЃКЂй![]() ЃЌЂк
ЃЌЂк![]() ЃЌдђЧАепБШКѓепПь
ЃЌдђЧАепБШКѓепПь
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
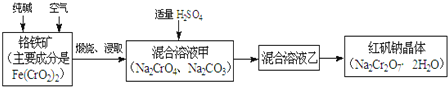
ЁОЬтФПЁПУїЗЏЪЏЕФжївЊГЩЗжЪЧK2SO4ЁЄAl2(SO4)3ЁЄ2Al2O3ЁЄ6H2OЃЌЛЙКЌгаЩйСПFe2O3дгжЪЁЃРћгУУїЗЏЪЏжЦБИЧтбѕЛЏТСЕФСїГЬШчЯТЃК

(1)БКЩеТЏжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ2Al2(SO4)3+3S![]() 2Al2O3+9SO2ЃЌИУЗДгІЕФбѕЛЏМСЪЧ_______ЁЃШєЩњГЩl molAl2O3ЃЌдђзЊвЦЕФЕчзгЪ§ЮЊ__________________ЁЃ
2Al2O3+9SO2ЃЌИУЗДгІЕФбѕЛЏМСЪЧ_______ЁЃШєЩњГЩl molAl2O3ЃЌдђзЊвЦЕФЕчзгЪ§ЮЊ__________________ЁЃ
(2)ЪьСЯШмНтЪБЃЌЗДгІЕФРызгЗНГЬЪНЮЊ___________________________________________ЁЃ
(3)ФИвКжаШмжЪжївЊГЩЗжЕФЛЏбЇЪНЮЊ_____________________________________________ЁЃ
(4)НЋБъзМзДПіЯТ1.12LТЏЦјЭЈШы100mL 0ЃЎ5molЁЄL-1NaOHШмвКжаЃЌЕУЕНвЛжжЫсадШмвКЃЌдђИУШмвКжаИїжжРызгХЈЖШгЩДѓЕНаЁЕФХХСаЫГађЮЊ____________________________ЁЃ
(5)МьбщЗЯдќжажївЊГЩЗжЕФЗНЗЈЪЧ_____________________________________________________(аДГіВйзїВНжшЁЂЯжЯѓМАНсТл)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжиИѕЫсФЦЫзГЦКьЗЏФЦ![]() ЃЌЪЧживЊЕФЛЏЙЄВњЦЗКЭЧПбѕЛЏМСЃЎЙЄвЕжЦБИКьЗЏФЦЕФСїГЬШчЯТЃК
ЃЌЪЧживЊЕФЛЏЙЄВњЦЗКЭЧПбѕЛЏМСЃЎЙЄвЕжЦБИКьЗЏФЦЕФСїГЬШчЯТЃК
(1)ЛЏбЇЩЯПЩНЋФГаЉбЮаДГЩбѕЛЏЮяЕФаЮЪНЃЌШч![]() ПЩаДГЩ
ПЩаДГЩ![]() ЃЌдђ
ЃЌдђ![]() ПЩаДГЩ______ЃЎ
ПЩаДГЩ______ЃЎ
(2)ьбЩеИѕЬњПѓЪБЃЌПѓЪЏжаФбШмЕФ![]() ЩњГЩПЩШмгкЫЎЕФ
ЩњГЩПЩШмгкЫЎЕФ![]() ЃЌЗДгІЛЏбЇЗНГЬЪНШчЯТЃК
ЃЌЗДгІЛЏбЇЗНГЬЪНШчЯТЃК![]() ЮЊСЫМгПьИУЗДгІЕФЗДгІЫйТЪЃЌПЩВЩШЁЕФДыЪЉЪЧ______
ЮЊСЫМгПьИУЗДгІЕФЗДгІЫйТЪЃЌПЩВЩШЁЕФДыЪЉЪЧ______![]() аДвЛжжМДПЩ
аДвЛжжМДПЩ![]()
(3)вбжЊ![]() дкВЛЭЌЕФЫсадШмвКжагаВЛЭЌЕФЗДгІЃЌШчЃК
дкВЛЭЌЕФЫсадШмвКжагаВЛЭЌЕФЗДгІЃЌШчЃК
![]() ЃЛ
ЃЛ![]()
ЂйЭљЛьКЯШмвКМзжаМгШыСђЫсБиаыЪЪСПЕФдвђЪЧ______ЃЎ
ЂкЛьКЯШмвКввжаШмжЪЕФЛЏбЇЪНЪЧ______ЃЎ
(4)дкКЌ![]() ЗЯЫЎжаДцдкзХЦНКтЃК
ЗЯЫЎжаДцдкзХЦНКтЃК![]() ЃЌЧыаДГіИУЦНКтЕФЦНКтГЃЪ§БэДяЪН
ЃЌЧыаДГіИУЦНКтЕФЦНКтГЃЪ§БэДяЪН![]() ______ЃЌШєМЬајМгЫЎЯЁЪЭЃЌЦНКтНЋ______вЦЖЏ
______ЃЌШєМЬајМгЫЎЯЁЪЭЃЌЦНКтНЋ______вЦЖЏ![]() ЬюЁАе§ЯђЁБЁЂЁАФцЯђЁБЁАВЛЁБ
ЬюЁАе§ЯђЁБЁЂЁАФцЯђЁБЁАВЛЁБ![]() ЃЎ
ЃЎ
(5)ЧыХфЦНМюадШмвКЛЙдЗЈжаЗЂЩњЕФРызгЗДгІЃК
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() ЃЎ
ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТгУЙ§СПЬњПщгыЯЁСђЫсЗДгІжЦШЁЧтЦјЃЌВЩШЁЯТСаДыЪЉЃКЂйНЋЬњПщЛЛЮЊЕШжЪСПЕФЬњЗлЃЛЂкМгШыЩйСП![]() ШмвКЃЛЂлМгШыЩйСП
ШмвКЃЛЂлМгШыЩйСП![]() ЙЬЬхЃЛЂмМгШыЩйСПЫЎЃЛЂнМгШШЃЛЂоНЋЯЁСђЫсЛЛЮЊ98%ЕФСђЫсЃЌЦфжаПЩЬсИпЗДгІЫйТЪЕФДыЪЉгаЁЁЁЁ
ЙЬЬхЃЛЂмМгШыЩйСПЫЎЃЛЂнМгШШЃЛЂоНЋЯЁСђЫсЛЛЮЊ98%ЕФСђЫсЃЌЦфжаПЩЬсИпЗДгІЫйТЪЕФДыЪЉгаЁЁЁЁ
A.ЂйЂлЂмB.ЂйЂлЂнC.ЂкЂмЂнD.ЂкЂнЂо
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЦЯЬбЬЧЫсбЧЬњ[(C6H11O7)2Fe]ЪЧвНСЦЩЯГЃгУЕФВЙЬњМСЃЌвзШмгкЫЎЃЌМИКѕВЛШмгкввДМЁЃФГЪЕбщаЁзщЭЌбЇФтгУЯТЭМзАжУЯШжЦБИFeCO3ЃЌдйгУFeCO3гыЦЯЬбЬЧЫсЗДгІНјвЛВНжЦЕУЦЯЬбЬЧЫсбЧЬњЁЃ
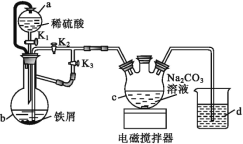
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгыЦеЭЈТЉЖЗБШНЯЃЌaТЉЖЗЕФгХЕуЪЧ___ЁЃ
ЃЈ2ЃЉАДШчЭМСЌНгКУзАжУЃЌМьЫЦјУмадКѓМгШывЉЦЗЃЌДђПЊK1КЭK3ЃЌЙиБеK2ЁЃ
ЂйbжаЕФЪЕбщЯжЯѓ___ЁЃ
ЂквЛЖЮЪБМфКѓЃЌЙиБе___ЃЌДђПЊ___(бЁЬюЁАK1ЁБЁАK2ЁБЛђЁАK3ЁБ)ЃЌЙлВьЕНbжаЕФШмвКЛсСїШыcжаЃЌЭЌЪБcжаЮіГіFeCO3ГСЕэЁЃ
ЂлbжаВњЩњЕФЦјЬхЕФзїгУЪЧ___ЁЃ
ЃЈ3ЃЉНЋcжажЦЕУЕФЬМЫсбЧЬњдкПеЦјжаЙ§ТЫЪБМфНЯГЄЪБЃЌБэУцЛсБфЮЊКьКжЩЋЃЌгУЛЏбЇЗНГЬЪНЫЕУїЦфдвђЃК___ЁЃ
ЃЈ4ЃЉНЋЦЯЬбЬЧЫсгыЬМЫсбЧЬњЛьКЯЃЌаыНЋШмвКЕФpHЕїНкжС5.8ЃЌЦфдвђЪЧ___ЁЃЯђЩЯЪіШмвКжаМгШыввДММДПЩЮіГіВњЦЗЃЌМгШыввДМЕФФПЕФЪЧ___ЁЃ
ЃЈ5ЃЉгаЭЌбЇЬсГігУNaHCO3ШмвКДњЬцNa2CO3ШмвКжЦЕУЕФЬМЫсбЧЬњДПЖШИќИпЃЌЦфПЩФмЕФдвђЪЧ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвГЃРћгУМзШЉЗЈВтЖЈ(NH4)2SO4бљЦЗжаЕЊЕФжЪСПЗжЪ§ЃЌЦфЗДгІдРэЮЊЃК4NH![]() ЃЋ6HCHO=3HЃЋЃЋ6H2OЃЋ(CH2)6N4HЃЋ[ЕЮЖЈЪБЃЌ1 mol (CH2)6N4HЃЋгы1 mol HЃЋЯрЕБ]ЃЌШЛКѓгУNaOHБъзМШмвКЕЮЖЈЗДгІЩњГЩЕФЫсЁЃФГаЫШЄаЁзщгУМзШЉЗЈНјааСЫШчЯТЪЕбщЃК
ЃЋ6HCHO=3HЃЋЃЋ6H2OЃЋ(CH2)6N4HЃЋ[ЕЮЖЈЪБЃЌ1 mol (CH2)6N4HЃЋгы1 mol HЃЋЯрЕБ]ЃЌШЛКѓгУNaOHБъзМШмвКЕЮЖЈЗДгІЩњГЩЕФЫсЁЃФГаЫШЄаЁзщгУМзШЉЗЈНјааСЫШчЯТЪЕбщЃК
ВНжшЂёЁЁГЦШЁбљЦЗ1.5 gЃЛ
ВНжшЂђЁЁНЋбљЦЗШмНтКѓЃЌЭъШЋзЊвЦЕН250 mLШнСПЦПжаЃЌЖЈШнЃЌГфЗжвЁдШЃЛ
ВНжшЂѓЁЁвЦШЁ25.00 mLбљЦЗШмвКгк250 mLзЖаЮЦПжаЃЌМгШы10 mL 20%ЕФжаадМзШЉШмвКЃЌвЁдШЁЂОВжУ5 minКѓЃЌМгШы1ЁЋ2ЕЮЗгЬЊШмвКЃЌгУNaOHБъзМШмвКЕЮЖЈжСжеЕуЁЃАДЩЯЪіВйзїЗНЗЈдйжиИД2ДЮЁЃ
(1)ИљОнВНжшЂѓЬюПеЃК
ЂйNaOHБъзМШмвКЪЂЗХдк____ЕЮЖЈЙмжаЃЌШєЕЮЖЈЙмгУеєСѓЫЎЯДЕгКѓЃЌжБНгМгШыNaOHБъзМШмвКНјааЕЮЖЈЃЌдђВтЕУбљЦЗжаЕЊдЊЫиЕФжЪСПЗжЪ§________(ЬюЁАЦЋДѓЁБЁАЦЋаЁЁБЛђЁАЮогАЯьЁБ)ЁЃ
ЂкЕЮЖЈДяЕНжеЕуЪБЃЌЗгЬЊжИЪОМСгЩ________ЩЋБфГЩ________ЩЋЁЃ
ЂлЯТСагаЙиЪЕбщВйзїЕФЫЕЗЈе§ШЗЕФЪЧ__________(ЫЋбЁ)ЁЃ
AЃЎзЖаЮЦПгУеєСѓЫЎЯДЕгКѓЃЌЫЎЮДЕЙОЁЃЌдђЕЮЖЈЪБгУШЅNaOHБъзМШмвКЕФЬхЛ§ВЛБф
BЃЎЕЮЖЈжеЕуЪБЃЌИЉЪгЖСЪ§ЃЌЪЙВтЖЈНсЙћЦЋаЁ
CЃЎжЛФмбЁгУЗгЬЊзїжИЪОМС
DЃЎЕЮШызюКѓвЛЕЮNaOHШмвКЃЌШмвКЭЛШЛБфЩЋЃЌМДЮЊЕЮЖЈжеЕу
EЃЎЕЮЖЈЪБЃЌзѓЪжПижЦЕЮЖЈЙмЛюШћЃЌгвЪжЮеГжзЖаЮЦПЃЌБпЕЮБпеёЕДЃЌблОІзЂЪгЕЮЖЈЙмжаЕФвКУц
(2)ЕЮЖЈНсЙћШчЯТБэЫљЪОЃК
ЕЮЖЈДЮЪ§ | Д§ВтШмвКЕФЬхЛ§/mL | БъзМШмвКЕФЬхЛ§/mL | |
ЕЮЖЈЧАПЬЖШ | ЕЮЖЈКѓПЬЖШ | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
дђЫљгУШЅЕФNaOHБъзМШмвКЕФЦНОљЬхЛ§ЮЊ_______ mLЃЌШєNaOHБъзМШмвКЕФХЈЖШЮЊ0.100 0 molЁЄLЃ1ЃЌдђИУбљЦЗжаЕЊдЊЫиЕФжЪСПЗжЪ§ЮЊ___________ЁЃ(СаГіМЦЫуЪНВЂМЦЫуНсЙћ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМСНдВЯрНЛВПЗжAЁЂBЁЂCЁЂDЗжБ№БэЪОСНЮяжЪМфЕФЗДгІЁЃЯТСаИїЖдгІЗДгІЕФРызгЗНГЬЪНЪщаДВЛе§ШЗЕФЪЧ(ЁЁЁЁ)

A.FeЃЋ4HЃЋЃЋNO3-=Fe3ЃЋЃЋNOЁќЃЋ2H2O
B.Fe(OH)3ЃЋ3HЃЋ=Fe3ЃЋЃЋ3H2O
C.Fe3O4ЃЋ8HЃЋ=Fe2ЃЋЃЋ2Fe3ЃЋЃЋ4H2O
D.3Fe(OH)2ЃЋ10HЃЋЃЋNO3-=3Fe3ЃЋЃЋNOЁќЃЋ8H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧЬњЧшЛЏМи(K4[Fe(CN)6])гжГЦЛЦбЊбЮЃЌгУгкМьбщFe3+ЃЌвВгУзїЪЕбщЕФЗРНсМСЁЃМьбщШ§МлЬњЗЂЩњЕФЗДгІЮЊЃКK4[Fe(CN)6]+FeCl3ЃНKFe[Fe(CN)6]Ё§(ыјЪЯРЖ)+3KClЃЌЛиД№ЮЪЬтЃК
(1)Fe3+ЕФКЫЭтЕчзгХХВМЪН_________ЃЛ
(2)гыCN-ЛЅЮЊЕШЕчзгЬхЕФЗжзгЪЧ______ЃЌK4[Fe(CN)6]жаЕФзїгУСІГ§РызгМќКЭЙВМлМќЭтЃЌЛЙга_______ЁЃКЌга12mol ІвМќЕФK4[Fe(CN)6]ЕФЮяжЪЕФСПЮЊ_______molЁЃ
(3)ЛЦбЊбЮжаCдзгЕФдгЛЏЗНЪНЮЊ______ЃЛCЁЂNЁЂOЕФЕквЛЕчРыФмгЩДѓЕНаЁЕФХХађЮЊ________ЃЛ
(4)FeЁЂNaЁЂKЕФОЇЬхНсЙЙШчЭМЫљЪОЁЃ

ЂйФЦЕФШлЕуБШМиИќИпЃЌдвђЪЧ__________ЃЛ
ЂкFeдзгАыОЖЪЧr cmЃЌАЂЗќМгЕТТоГЃЪ§ЮЊNAЃЌЬњЕФЯрЖддзгжЪСПЮЊaЃЌдђЬњЕЅжЪЕФУмЖШЪЧ_____g/cm3ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com