
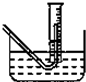
 Na2O2与水的反应实际可以分解为两个阶段:Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际可以分解为两个阶段:Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:| 过氧化钠质量 |
| 混合物的总质量 |
| 0.112L |
| 22.4L/mol |
| 5×24.4×0.01×10-3×10 |
| 2 |
| 0.0016mol×78g/mol |
| 2.0g |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
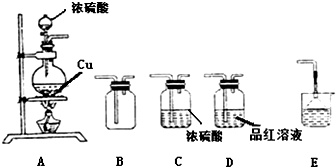
 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.查看答案和解析>>
科目:高中化学 来源: 题型:
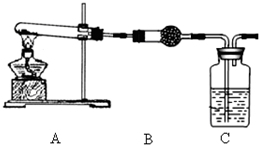
查看答案和解析>>
科目:高中化学 来源: 题型:
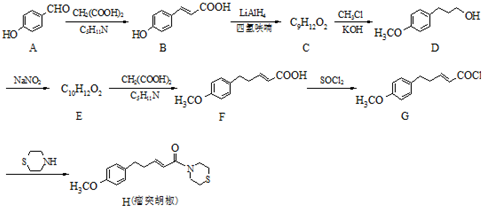
| NaNO2 |
| ①O3 |
| ②Zn/H2O |
 是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及 (无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.
(无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |

查看答案和解析>>
科目:高中化学 来源: 题型:

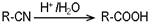 .请回答下列问题:
.请回答下列问题: ),请设计合成路线(无机试剂及溶剂任选).
),请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠和氯化镁溶液分别与硝酸银溶液混合都能产生白色沉淀 |
| B、浓硫酸和稀盐酸长期暴露在空气中浓度降低 |
| C、氯水和活性炭使红墨水褪色 |
| D、漂白粉和水玻璃长期暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com