
| A、24 g镁的原子最外层电子数为NA |
| B、1 L 0.1 mol?L-1硫酸溶液中H+数为0.1NA |
| C、1 mol甲烷分子所含质子数为10NA |
| D、标准状况下,22.4 L乙醇的分子数为NA |
| m |
| M |
| 24g |
| 24g/mol |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |
| N | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X元素的电子排布式为:1S22S22P63S23P63d104s24p64d65s2 |
| B、X元素位于第五周期 |
| C、X元素位于VIB族 |
| D、X元素原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
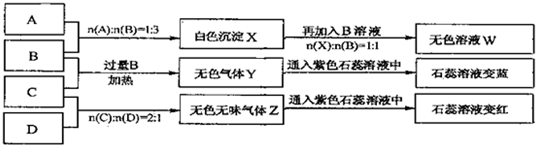
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2- 1s22s22p4 |
| B、Ca[Ar]3d2 |
| C、Si 1s22s22p63s23p2 |
| D、Zn[Ar]3d104s1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com