
 CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | — | — | — |
 (1分)
(1分) ;
;

科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )
PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )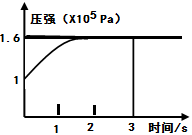
| A.3s内的平均速率为:V(PCl3)=0.1mol·L-1·min-1 |
| B.达到平衡时放出0.6QKJ热量 |
| C.其他条件不变,再向容器中充入1molPCl5(g),则达新平衡 时,C(PCl5)>0.4mol·L-1 |
| D.其他条件不变,增大PCl5的浓度,平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):

 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 2N2+6H2O
2N2+6H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是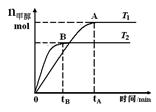
A.平衡常数K=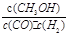 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.任意时刻,T2温度下的反应速率均大于T1温度下的速率 |
D.处于A点的反应体系从T1变到T2,达到平衡时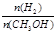 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 |
| B.正反应是吸热反应 |
| C.t3时刻可能是增大了压强 |
| D.t3时刻可能是降低了温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2(g)+2CO2(g) △H=-373.4kJ/mol
N2(g)+2CO2(g) △H=-373.4kJ/mol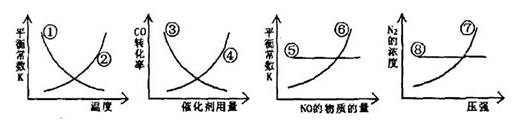
| A.①⑥⑧ | B.①⑤⑦ | C.②③④ | D.③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )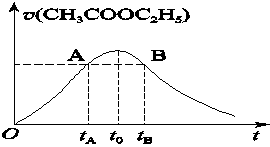
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com