
| 56L |
| 22.4L/mol |
| 2.5mol×2NA |
| 2mol |
| 5.0g |
| (23+27)g/mol |
| 0.1mol |
| 0.1L |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
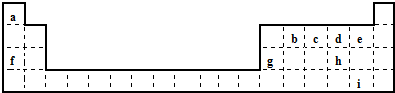
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 化合物,但不是电解质 | |
| (5) | 不是电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
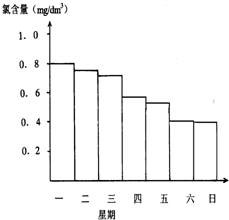 游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,
游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
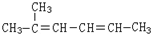
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
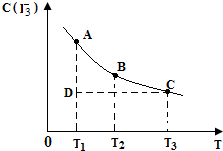 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)| A、反应I2(aq)+I-(aq)═I3-(aq)的△H>0 |
| B、状态A与状态B相比,状态A的c(I2)大 |
| C、若反应进行到状态D时,一定有v正>v逆 |
| D、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com