
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 Al Al 元素假设②:该混合金属粉末中除镁外还含有 Zn Zn 元素假设③:该混合金属粉末中除镁外还含有铝、锌元素 ●实验探究: 甲同学基于假设③设计实验方案如下:乙同学同样基于假设③设计另一实验方案如下: 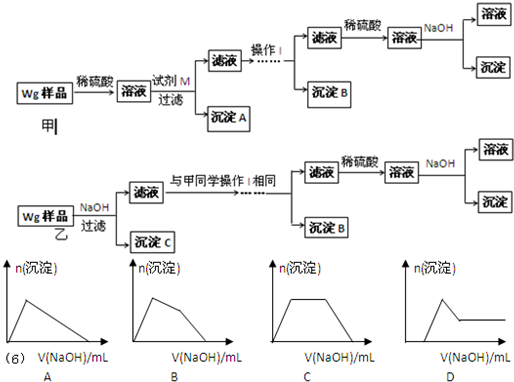 (2)试剂M是 NaOH溶液 NaOH溶液 ;沉淀B是Al(OH)3 Al(OH)3 .(3)丙同学认为乙同学的方案比甲同学的好,理由是 步骤简单,节约试剂 步骤简单,节约试剂 .(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 将沉淀C洗涤、小心干燥后称量 将沉淀C洗涤、小心干燥后称量 .(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 稀硫酸 稀硫酸 ,直至生成的沉淀刚好溶解,再加入足量的稀氨水 稀氨水 .(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图象正确的是 B B .
分析:(1)根据粉末的可能组成,对粉末进行合理的猜想; (2)根据甲同学基于假设③设计实验方案,样品加入酸之后生成了镁盐、铝盐和锌盐,镁盐加过量的强碱生成了沉淀不溶解,而铝盐和锌盐加过量的强碱先生成了沉淀然后沉淀溶解;而镁盐、铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,锌盐加过量的弱碱先生成了沉淀然后沉淀溶解,由实验方案可知镁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Mg(OH)2,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀; (3)根据对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸; (4)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离; (5)根据反应的先后顺序以及量的关系来分析. 解答:解:(1)除Mg外,还含有Al、Zn中的一种或两种,因此粉末的组成有三种可能,即除Mg外只含Al、只含Zn、或既含Al又含Zn,故答案为:Al;Zn; (2)由实验方案可知镁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Mg(OH)2,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,实现了Al(OH)3沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀,故答案为:NaOH溶液;Al(OH)3; (3)对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸,故答案为:步骤简单,节约试剂; (4)锌、铝都能与NaOH溶液反应溶解,而镁不能与NaOH溶液反应,所以只需将沉淀C洗涤、小心干燥后称量即可得到镁的质量,故答案为:将沉淀C洗涤、小心干燥后称量; (5)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)3沉淀的分离,故答案为:稀硫酸;稀氨水; (6)先发生的反应是Al3+和Zn2+与OH-生成沉淀,随后随着NaOH的加入,沉淀减少直至消失,此时是因为生成的沉淀都能溶解在NaOH溶液中,但Al(OH)3~NaOH,Zn(OH)2~2NaOH,所以相同物质的量的沉淀溶解消耗的NaOH不同,最后NH4+和OH-反应生成NH3?H2O,故选:B. 点评:本题主要考察了金属的性质以及实验方案的设计,难度较大,尤其是锌及其化合物性质的运用.  
练习册系列答案
 小学能力测试卷系列答案 小学能力测试卷系列答案
相关习题
科目:高中化学 来源: 题型:阅读理解 (2011?云浮模拟)硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一.如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图: 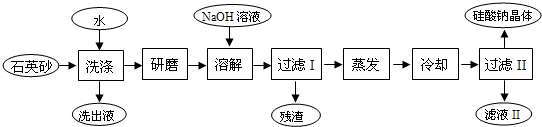 (1)要将上流程图中洗出液中的溶质析出,采用的方法是 A A .A.蒸发结晶 B.冷却结晶 C.先蒸发,再冷却结晶 D.先冷却,再蒸发结晶 (2)在以上流程中,要将洗净的石英砂研磨成粉末,目的是 C C .A.增加反应物的浓度,增大化学反应速率,提高生产效率. B.作为催化剂载体,增加反应物与催化剂接触面积,增加反应速率,提高生产效率. C.增加反应物之间的接触面积,增大反应速率,提高生产效率. D.增加正反应速率,减小逆反应速率,使平衡向正反应方向移动,降低生产成本. (3)蒸发时用到的硅酸盐仪器有 蒸发皿、玻璃棒、酒精灯 蒸发皿、玻璃棒、酒精灯 .(4)上流程中加入NaOH溶液,反应的离子方程式是 SO2+2OH-=SO32-+H2O SO2+2OH-=SO32-+H2O .(5)硅酸钠溶液呈碱性,其原因是(用一离子方程式表示) SiO32-+2H2O?H2SiO3+2OH- SiO32-+2H2O?H2SiO3+2OH- .硅酸钠的用途很广,其中的一种用途是黏合剂或防腐剂或合成洗涤剂或制备硅胶或分子筛 黏合剂或防腐剂或合成洗涤剂或制备硅胶或分子筛 .(6)用上流程中的残渣来焊接铁轨,反应的化学方程式是 2Al+Fe2O3
2Al+Fe2O3 .
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |