
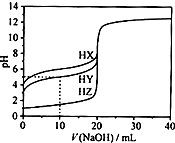
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的酸性强弱顺序:HZ<HY<HX | |
| B. | HZ、HY、HX均为弱酸 | |
| C. | 向HY溶液中加入10.00mLNaOH溶液,一定有c(Y-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
分析 A、根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,得到酸性强弱顺序;
B、A、根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,HZ为强酸,HX和HY为弱酸;
C、根据向HY溶液中加入10.00mLNaOH溶液后溶液中的电荷守恒来回答;
D、HX恰好完全反应时,HY早已经反应完毕,根据盐的水解原理:越弱越水解来判断.
解答 解:A、氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故A错误;
B、氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,HZ是强酸,故B错误;
C、用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度为0.1000mol•L-1的HY,向HY溶液中加入10.00mLNaOH溶液,得到的是等浓度的NaY和HY的混合物,此时溶液中存在电荷守恒:c(Y-)+c(OH-)═c(H+)+c(Na+),故C正确;
D、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,酸性大小为HX<HY,得到的是NaX和NaY的混合物,酸性 HX<HY,NaY水解程度小于NaX,故溶液中c(X-)<c(Y-),故D错误.
故选C.
点评 本题考查利用中和滴定图象,分析数据,用到了电荷守恒知识,难度适中.注意弱酸电离平衡的分析判断.


科目:高中化学 来源: 题型:解答题
 ,B的结构简式
,B的结构简式 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
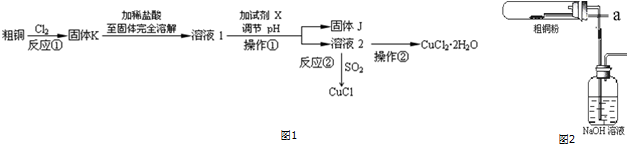
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
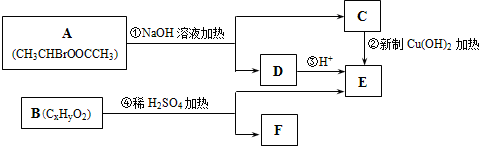
 .
. 、
、 、
、 、
、 任意1种.
任意1种.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
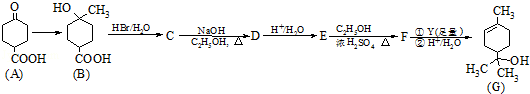
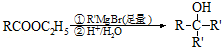
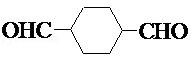 .
. .
.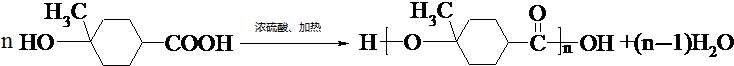 .
.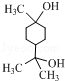 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
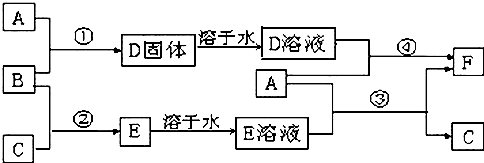
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
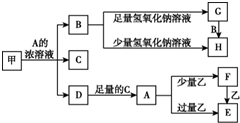 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com