
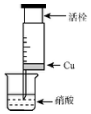
 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
分析 (1)硝酸具有强氧化性,能氧化单质铜生成硝酸铜,溶液呈蓝色,要验证NO,可利用其极易被氧气氧化生成红棕色二氧化氮来实现;
(2)因为反应中硝酸过量,而铜的质量也是相等的,即生成的硝酸铜的浓度是相同的,说以不可能是因为浓度差异引起,由于硝酸过量,而硝酸是不稳定的,在加热的条件下,硝酸也会分解生成二氧化氮,在氧气的作用下,生成硝酸,由于消耗了二氧化氮,所以溶液颜色显蓝色,根据原理可知方案1和3均引起环境污染,说以方案2是最好的.
解答 解:(1)①硝酸具有强氧化性,与铜反应生成硝酸铜,稀硝酸生成NO,NO气体无色,化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
故答案为:无;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
②要验证NO,可利用其极易被氧气氧化生成红棕色二氧化氮来实现,方法是往针筒内抽气,气体由无色变红棕色;
故答案为:往针筒内抽气,气体由无色变红棕色;
(2)①因为反应中硝酸过量,而铜的质量也是相等的,即生成的硝酸铜的浓度是相同的;
故答案为:不同意;相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同;
②硝酸是不稳定的,在加热的条件下,硝酸也会分解生成二氧化氮,二氧化氮和与氧气反应生成硝酸,反应的方程式为4NO2+O2+2H2O=4HNO3;
故答案为:过量的硝酸分解会产生红棕色的NO2;4NO2+O2+2H2O=4HNO3;
③方案一和三均引起环境污染,说以方案二是最好的;
故答案为:方案二.
点评 本题考查了铜与硝酸的反应,综合考查学生实验设计和探究能力,涉及硝酸的性质、物质验证性实验设计,利用对比的方法判断硝酸的性质,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用滴定管前要检查是否漏液 | |
| B. | 用简易量热计测定反应热时,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应,以达到良好的实验效果 | |
| C. | 用精密pH试纸测得某浓度氯水的pH为3.5 | |
| D. | 燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:3 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CHCl3含有的原子总数为2.5NA | |
| B. | 25g质量分数为68%的H2O2溶液中含有氧原子数目为NA | |
| C. | 高温下,16.8gFe与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 1molCH5+中含有的电子数目为11NA |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:选择题
分类是化学学习与研究的常用方法,下列分类正确的是
A.Cl2O7、P2O5、SO3、CO2均属于酸性氧化物
B.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com