
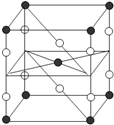
 F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )
F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )| A、XeF2分子中各原子均达到八电子结构 | B、某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6 | C、XeF4按已知方式水解,每生成4molXe,转移16mol电子 | D、XeF2加入水中,在水分子作用下将重新生成Xe和F2 |
| 1 |
| 8 |
| 1 |
| 4 |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。
下列判断中正确的是
A.XeF2分子中各原子均达到八电子结构
B.XeF6分子中Xe的化合价为+6价
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。
下列判断中正确的是
A.F一般无正价,但在HFO中的F价态为+1
B.XeF2分子中各原子均达到8电子结构
C.XeF4按已知方式水解,反应中氧化剂为XeF4、还原剂为H2O
D.XeF4按已知方式水解,每生成4molXe,转移16mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com