
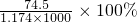
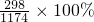 ,故B错误;
,故B错误;

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1 | ||
| B、Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等 | ||
| C、质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10% | ||
D、20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0 mol?L-1,则此溶液中KCl的质量分数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g/cm3 | ||
B、此溶液中KCl的质量分数为
| ||
| C、20℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液 | ||
| D、25℃时,饱和KCl溶液的浓度大于4.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com