
����Ŀ���������������������壬�Ǿ�����������ֲ���������ڼ���ʵ��֤������ʹ�ö�����������֪��������������ʾ��
����ʽ | �ṹ��ʽ | ��� | �۵� | �ܽ��� |
C12H10ClN3O |
| ��ɫ�ᾧ��ĩ | 170��172��C | ������ˮ |
��1����Ԫ�ػ�̬ԭ�Ӻ�����ӵijɶԵ�����Ϊ �� ��������������Ԫ�����γ�10���ӷ��ӣ��ҷ���֮�����γ�������� �� ������֣��ѧʽ��
��2����������ľ�������Ϊ���壮�÷����������γɵ����ӣ�����ԡ��Ǽ��ԡ���
���𰸡�
��1��16��NH3��H2O
��2�����ӣ����ԡ��Ǽ��ԣ�����
���������⣺��1�����ݹ���ԭ����֪����Ԫ�ػ�̬ԭ�Ӻ�����ӵ��Ų�ʽ��1s22s22p63s23p5 �� ���ԳɶԵ�����Ϊ16����N��O��H֮���γɵ�10���ӷ���Ϊ������ˮ��������ˮ�����γ������ ���Դ��ǣ�16��NH3��H2O����2������������۵�ϵͣ�������ˮ�������侧�������Ƿ��Ӿ��壻��ͬԪ��֮���γɼ��Լ���ͬ��Ԫ��֮���γɷǼ��Լ����÷����к��м��Լ��ͷǼ��Լ������ӹ��ɲ��Գƣ�����������IJ��ص������Է���Ϊ���Է��ӣ�
���Դ��ǣ����ӣ����ԡ��Ǽ��ԣ����ԣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵı��治��ȷ����
A.Ư�ۿ�¶���ڿ����б���B.������Ӧ��ú��Һ��
C.Һ��Ӧ��ˮ���D.AgI��AgBrӦ��������ɫƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȡ���ӵ�ˮ�з�����⣬������ȡ��Ӧ���е�������(����)
�ٲ��͵�ˮ������ѧ��Ӧ�� ��������ˮ����Ӧ�Ǽ����ܼ��� �ܲ�����ˮ����Ӧ�ǷǼ����ܼ���
A. �٢ܢ�B. �٢ۢ�C. �٢ڢ�D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20g��������Ϊ14%��KNO3��Һ��30g��������Ϊ24%��KNO3��Һ��ϣ��õ����ܶ�Ϊ1.26 g/mL�Ļ����Һ�����㣺
��1����Ϻ���Һ������������
��2����Ϻ���Һ�����ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ�ֻ�ѧԪ�أ��Իش��������⣺ 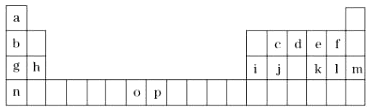
��1��Ԫ��oΪ25��Ԫ�أ���д�����̬ԭ�ӵĵ����Ų�ʽ ��
��2��d��a��Ӧ�IJ���ķ����У�����ԭ�ӵ��ӻ���ʽΪ ��
��3��d��e��f����Ԫ�صĵ縺�Դ�С˳��Ϊ����Ԫ�ط��ű�ʾ�� ��
��4��o��p��Ԫ�صIJ��ֵ������������ڱ���
Ԫ�� | O | P | |
������/KJmol��1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
�Ƚ���Ԫ�ص�I2��I3��֪����̬o2+��ʧȥһ�����ӱ���̬p2+��ʧȥһ�������ѣ��Դˣ���Ľ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Sn���˵����Ϊ50������������ʹ�õ�Ԫ��֮һ�����γ�SnCl2 �� SnCl4�����Ȼ��SnCl2������Ϊ��ɫ���壬����һά��״�ľۺϽṹ����̬ʱ�Ե�������ʽ���ڣ���SnCl4������Ϊ��ɫҺ�壮�����ͻ�����Sn������ͬ�������壬�����ľ���ṹ��Snԭ�ӵ���λ��Ϊ4��6�������ľ���ṹ����ʯ�ľ���ṹ���ƣ��������ܶȴ��ڻ������ܶȣ� 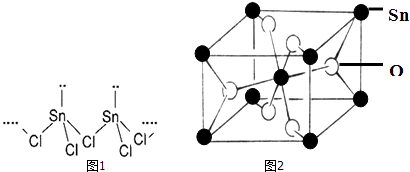
��1��SnԪ����Χ�����Ų�ʽΪ ��
��2��SnCl2��һά��״�ۺϽṹ��ͼ1��ʾ���ڷ��ӽṹ�д��ڵĻ�ѧ���� ��
��3��SnCl4��CCl4�зе�ϸߵ��� �� ԭ���� ��
��4������ij��������ľ�����ͼ2���仯ѧʽΪ ��
��5�����Ͱ������ӵ��ܶȴ��ڻ������ܶȵ�ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)
A. ����£�1mol�κ����ʵ������ԼΪ22.4L
B. 1mol��������ԼΪ22.4L
C. ����£�1molO2��N2�����(�����)�����ԼΪ22.4L
D. 22.4L��������������һ������11.2L���������ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ���� �� ��
A. 12g̼������ԭ�������ǰ����ӵ�����
B. �����ӵ�����û�е�λ
C. �����ʵ�����ָ���ʵ�����
D. Ħ���DZ�ʾ���ʵ����ĵ�λ��ÿĦ�����ʺ��а����ӵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ�� ![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
��֪��
��ɫ��״̬ | �е㣨�棩 | �ܶȣ�gcm��3�� | |
������* | ��ɫƬ״���� | 249 | 1.2659 |
���������� | ��ɫ����Һ�� | 212.6 | 1.05 |
�Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 |
������ | ��ɫ����Һ�� | 80.8 | 0.7318 |
*��������100���Ѹ��������ʵ�鲽�����£�
����Բ����ƿ�м���12.20g�����ᡢ25mL�Ҵ�����������20mL �����飬�Լ�4mLŨ���ᣬ��Ͼ��Ȳ������ʯ������ͼ��ʾװ�������������¶���6570����Ȼ���2h����Ӧʱ������һ�Ҵ���ˮ���γɡ���������е�62.6�棩��������������÷�ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��������������Ҵ���
�ڷ�Ӧ�������������ų���ˮ����Һ��ر��������������ȣ�����ˮ�����ռ�����Һ�岻���������ӣ�ֹͣ���ȣ�
�۽���ƿ�ڷ�ӦҺ����ʢ������ˮ���ձ��У���������Na2CO3����Һ�����ԣ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Һ��Ȼ��ϲ����л��㣮�����Ȼ��ƣ��Դֲ����������װ����ͼ��ʾ���������������Ѻ������£�����210213�����֣�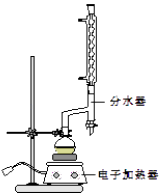
�ݼ���ϸ�ò�Ʒ���Ϊ13.16mL��
��1���ڸ�ʵ���У�Բ����ƿ���ݻ����ʺϵ�����������ȷѡ��ǰ����ĸ����
A.25mL
B.50mL
C.100mL
D.250mL
��2��������з�ʯ�������� �� ʹ�÷�ˮ�����Ϸ����ȥˮ��Ŀ���� ��
��3�������Ӧ������ֵ��¶�����
A.215220��
B.8590��
C.7880��
D.6570��
��4������ۼ���Na2CO3������������Na2CO3���벻�㣬��֮������ʱ��������ƿ�пɼ����������ɣ������������ԭ���� ��
��5�����ڲ�����е���ȡ��Һ����������ȷ����
A.ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������Һ©����ת������������ҡ
B.��ҡ���κ����Һ©���¿ڵIJ���������
C.��������ҡ���������ֳַ�Һ©�����ô�Һ��ֲ�
D.�ų�Һ��ʱ��Ӧ���Ͽڲ������������ϵİ��۶�©�����ϵ�С��
��6�����㱾ʵ��IJ���Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com