
| A.(c-a-b)kJ | B.(a+b-c)kJ |
| C.(2c-a-b)kJ | D.(2c-a-b)/2kJ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:计算题
 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:| A.密闭容器中总压强不变 |
| B.密闭容器中混合气体的平均摩尔质量不变 |
| C.密闭容器中混合气体的密度不变 |
| D.c(CO)= c(CO2) |
 2Fe3O4(s)+CO2(g) △H="–47" kJ/mol
2Fe3O4(s)+CO2(g) △H="–47" kJ/mol 3FeO(s)+CO2(g) △H=" +19" kJ/mol
3FeO(s)+CO2(g) △H=" +19" kJ/mol Fe(s)+CO2(g) △H="–11" kJ/mol
Fe(s)+CO2(g) △H="–11" kJ/mol 2Fe(s)+3CO2(g)的△H= 。
2Fe(s)+3CO2(g)的△H= 。| 温度 | 250℃ ~ 600℃ ~ 1000℃ ~ 2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=+817.63 kJ·mol-1 |
| B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-641.63 kJ·mol-1 |
| C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=-641.63 kJ·mol-1 |
| D.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-817.63 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0  O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH(l) + CH3COOH(l) ;△H
CH3CH2OH(l) + CH3COOH(l) ;△H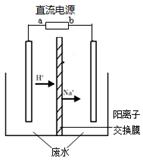
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com