
| A. | 10ml | B. | 30ml | C. | 50ml | D. | 70ml |
分析 若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.05mol×3=0.15mol,加入NaOH溶液的体积为$\frac{0.15mol}{5mol/L}$=0.03L,即为30mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
Al(OH)3+OH-═AlO2-+2H2O
(0.1-0.05)mol 0.05mol
则消耗的碱的物质的量为0.3mol+0.05mol=0.35mol,
加入NaOH溶液的体积为$\frac{0.35mol}{5mol/L}$=0.07L,即为70mL,
故选:BD.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
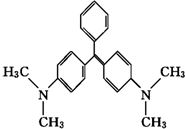 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )| A. | 孔雀石绿的分子式为C23H25N2 | |
| B. | 1 mol孔雀石绿在一定条件下最多可与6 mol H2发生加成反应 | |
| C. | 孔雀石绿属于芳香族化合物 | |
| D. | 孔雀石绿苯环上的一氯取代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H14含有四个甲基的烃的一氯取代物的异构体数目为5 | |
| B. | 分子式为C5H10异构体数目为5 | |
| C. | 分子式为C4H10O的醇类异构体数目为4 | |
| D. | 分子式为C6H12O2羧酸类异构体数目为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C3H8O | C4H8Cl2 | C7H16 | C8H10 |
| 限定条件 | 能使KMnO4溶液褪色 | 分子中含有2个甲基 | 分子中含有3个甲基 | 芳香烃、能得到三种一硝基化物 |
| 数目 | 2 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com