
分析 (1)碳酸氢钠是强碱弱酸盐,溶液中碳酸氢根离子为弱酸的酸式根离子水解生成碳酸和氢氧根离子;
(2)FeCl3是强酸弱碱盐,铁离子水解而使其溶液呈酸性;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧Fe(OH)3时,Fe(OH)3会分解生成氧化铁和水,若把NaHCO3溶液和FeCl3溶液混合发生双水解反应生成氢氧化铁红褐色沉淀和二氧化碳气体;
(3)氯化钠和硝酸银反应生成氯化银和硝酸钠,观察到白色沉淀,AgCl中加入2mL0.1mol/L的KI溶液发生沉淀的转化,生成AgI.
解答 解:(1)NaHCO3溶液呈碱性原因是碳酸氢根离子水解生成氢氧根离子,离子方程式:HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(2)FeCl3是强酸弱碱盐,铁离子水解生成Fe(OH)3和HCl而使其溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,若把NaHCO3溶液和FeCl3溶液混合发生双水解反应生成氢氧化铁红褐色沉淀和二氧化碳气体,反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑+H2O,
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;Fe2O3;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑+H2O;
(3)在2mL 0.1mol/L的NaCl溶液中,加入2mL 0.1mol/L的AgNO3溶液,二者反应生成氯化银和硝酸钠,观察到白色沉淀,离子反应为Ag++Cl-=AgCl↓,AgCl中加入2mL0.1mol/L的KI溶液发生沉淀的转化,生成AgI,观察到白色沉淀转化为黄色沉淀,离子反应为AgCl (s)+I-=AgI(s)+Cl-,
故答案为:白色沉淀;白色沉淀转化为黄色沉淀;AgCl (s)+I-=AgI(s)+Cl-.
点评 本题考查综合考查盐类水解及应用,为高频考点,侧重考查学生的分析能力,主要把握盐的类型,蒸干盐溶液时,如果生成难挥发性酸和强碱,蒸干时得到盐本身,如果水解生成挥发性酸和碱,蒸干时得到碱,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 取10.00 mL硫酸:在25mL酸式滴定管中装入硫酸,调整初始读数为15.00mL后,将剩余硫酸放入锥形瓶 | |
| B. | 用乙酸浸泡水壶中的水垢,可将其清除,可以得出结论乙酸的酸性大于碳酸的酸性 | |
| C. | SO2的水溶液能够导电,所以SO2是电解质 | |
| D. | 测定醋酸溶液pH用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiCl4是氧化剂 | B. | Si3N4是氧化产物 | C. | H2被还原 | D. | N2发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
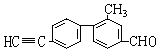
| A. | 分子中处于同一直线上的碳原子最多有7个 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 该有机物可发生加成反应和消去反应 | |
| D. | 该有机物分子式C16H10O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2>V3 | B. | V3>V2>V1 | C. | V3>V1=V2 | D. | V1>V2=V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 在加热和催化剂作用下,最多能和4mol H2反应 | |
| B. | 不能使溴的CCl4溶液褪色 | |
| C. | 不能发生氧化反应 | |
| D. | 一定条件下,能与乙酸发生酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com