
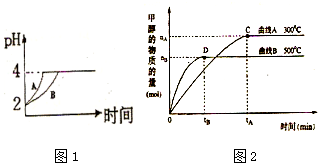
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:分析 (1)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多;
(2)化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积;化合反应一般为放热反应,升高温度平衡向吸热方向移动;用v=$\frac{△c}{△t}$求算;
(3)根据c(OH-)=$\sqrt{\frac{Ksp}{c(M{g}^{2+})}}$计算氢氧根离子浓度,从而确定溶液的pH,根据混合溶液中氢氧根离子浓度的平方与镁离子浓度的积与ksp比较,可判断;
(4)酚酞遇碱变红色,可知纯碱溶液呈碱性;向红色溶液中加入足量BaCl2溶液(或加热碳酸钠溶液),根据颜色的变化分析.
解答 解:(1)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(2)因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,所以K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,化合反应一般为放热反应,升高温度,平衡逆向移动,K值变小,v(H2)=$\frac{△c}{△t}$=$\frac{\frac{{n}_{B}mol}{3L}}{{t}_{B}}$=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min),
故答案为:减小;$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min);
(3)0.002mol•L-1MgSO4溶液中c(Mg2+)=0.0002mol/L,沉淀平衡时c(OH-)=$\sqrt{\frac{Ksp}{c(M{g}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-11}}{0.002}}$mol/L=10-4 mol/L,则c(H+)=10-10 mol/L,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10,在0.20L的0.002mol•L-1MgSO4溶液中加入等体积的0.10mol•L-1的氨水溶液,假设氨水的电离程度不变,则混合溶液中氢氧根离子浓度=$\sqrt{20}$×10-3 mol/L=4.45×10-3 mol/L>10-4 mol/L,所以有沉淀生成,
故答案为:10;有;
(4)酚酞遇碱变红色,该溶液呈红色说明是碱性溶液,要验证该溶液遇酚酞呈红色原因,可用以下方法,
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色褪去,说明乙正确;
方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确,
故答案为:取少量红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确;或加热,如果红色不变说明甲正确,如果红色加深,说明乙正确.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,为高考常见题型和高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性,注意把握弱电解质的电离特点和影响因素,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 300 mL0.1 mol/L NaCl溶液 | |
| B. | 100 mL0.1 mol/LFeCl3溶液 | |
| C. | 标准状况下,4.48LHC1气体溶于水配成的1 L溶液 | |
| D. | 向1 L0.2 mol/L BaCl2溶液中加入0.2 mol/L的H2SO4溶液到沉淀恰好完全时的溶液(忽略溶液混合时的体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于水的杀菌,消毒 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 目前加碘食盐主要添加的是KIO3 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com