

分析 (1)铁比铜活泼,为原电池的负极,发生氧化反应;
(2)铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,结合电极方程式解答该题;
(3)①根据固体不影响反应速率和化学平衡判断;根据反应物浓度增大,正反应速率增大,生成物物质的量增大完成;
②根据t1时逆反应速率变化判断改变的条件.
解答 解:(1)铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)设转移xmol电子,则消耗0.5xmolFe,析出0.5xmolCu,则有0.5x×(64+56)=1.2,x=0.02,故答案为:0.02;
(3)①在固体有剩余的情况下,增加或减少固体的质量,对反应速率以及限度均无影响;加入水蒸气,反应物浓度增大,正反应速率增大,氢气的物质的量增大,
故答案为:不变;增大;
②t1时反应未达到平衡,改变条件后逆反应速率突然增大,且继续增大,可知为加入催化剂或升高温度或增大气体反应物浓度,
故答案为:加入催化剂或升高温度;增大气体反应物浓度.
点评 本题考查原电池知识、化学反应速率的计算、化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理,把握电极方程式的书写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜中的铜,钠也能置换硫酸铜中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,无过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉、纤维素、油脂、蛋白质都属于高分子化合物 | |
| B. | 笔和墨的原料中都存在蛋白质 | |
| C. | 纸的主要成分属于糖类 | |
| D. | 将新鲜的土豆切开,一段时间后可观察到切面变蓝,说明土豆中含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
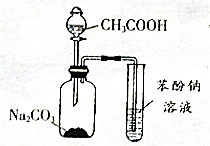 下列关于如图实验的说法错误的是( )
下列关于如图实验的说法错误的是( )| A. | 集气瓶中的离子方程式是:2CH3COOH+CO32-→2CH3COO-+H2O+CO2 ↑ | |
| B. | 少量的CO2通入苯酚钠中生成苯酚和碳酸钠 | |
| C. | 醋酸和苯酚钠发生反应 | |
| D. | 该装置和相关实验现象能推出酸性强弱顺序为:CH3COOH>H2CO3 >C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有些活泼金属,如铝可作还原剂法的还原剂 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com