
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
考点: 探究物质的组成或测量物质的含量.
专题: 实验探究和数据处理题.
分析: (一)(1)根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
(2)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(3)根据物质的性质和书写离子方程式的有关要求书写离子方程式;
(4)根据离子方程式计算,n(Fe)=5n(MnO4﹣)=5×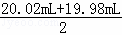 ×0.01 mol•L﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 g•mol﹣1×1.0×10﹣2mol=0.56g.晶体中铁的质量分数=
×0.01 mol•L﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 g•mol﹣1×1.0×10﹣2mol=0.56g.晶体中铁的质量分数=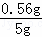 ×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(二)(5)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.
解答: 解:(一)(1)在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤,故答案为:溶解;定容;
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应;
(3)在步骤三中发生的离子反应为:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O;
(4)根据步骤三中的离子反应可知:n(Fe)=5n(MnO4﹣)=5×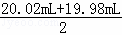 ×0.01 mol•L﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 g•mol﹣1×1.0×10﹣2mol=0.56g.晶体中铁的质量分数=
×0.01 mol•L﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 g•mol﹣1×1.0×10﹣2mol=0.56g.晶体中铁的质量分数=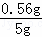 ×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,故答案为:11.2%;偏高;
×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,故答案为:11.2%;偏高;
(二)(5)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,故答案为:加热后的晶体要在干燥器中冷却; 两次称量质量差不超过0.1 g.
点评: 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.


科目:高中化学 来源: 题型:
某元素的一个原子形成的离子可表示为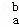 Xn﹣,下列说法正确的是( )
Xn﹣,下列说法正确的是( )
A. 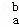 Xn﹣含有的中子数为a+b
Xn﹣含有的中子数为a+b
B. 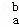 Xn﹣含有的电子数为a﹣n
Xn﹣含有的电子数为a﹣n
C. X原子的质量数为a+b+n
D. 一个X原子的质量约为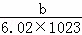 g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
依据事实,写出下列反应的热化学方程式.
(1)1molN2(g)与适量O2(g)反应生成NO2(g),吸收68kJ热量: ;
(2)1molCu(s)与适量O2(g)反应生成CuO(s),放出157kJ热量: ;
(3)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量:
(4)10g C2H6(g)完全燃烧生成CO2(g)和H2O(l),放出a kJ热量,写出表示C2H6燃烧热的热化学方程式:
(5)已知:WO2(s)+2H2(g)═W(s)+2H2O(g)△H=+66.0kJ/mol;WO2(g)+2H2(g)═W(s)+2H2O(g)△H=﹣137.9kJ/mol.则WO2(s)═WO2(g)的△H=
(6)已知:Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ/mol,2Al(l)+AlCl3(g)═3AlCl(g)△H=b kJ/mol,则反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H= J/mol(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10mol•L﹣1 NaHCO3溶液的说法正确的是()
A. 溶质的电离方程式为NaHCO3═Na++H++CO32﹣
B. 25℃时,加水稀释后,n(H+)与n(OH﹣)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
D. 温度升高,c(HCO3﹣)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是()
A. Cu溶于稀硝酸:Cu+2H++NO3﹣→Cu2++NO2↑+H2O
B. 在复盐NH4Fe(SO4)2溶液中逐滴加入一定量的Ba(OH)2溶液:2Fe3++3SO42﹣+3Ba2++6OH﹣→3BaSO4↓+2Fe(OH)3↓
C. 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D. 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2﹣+2H2O=Al(OH)3↓+HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
|
| A. | H2O(g)=H2(g)+ |
|
| B. | 2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 |
|
| C. | H2(g)+ |
|
| D. | 2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
|
| A. |
FeCl3+3KSCN⇌Fe(SCN)3+KCl(忽略液体体积变化) |
|
| B. |
2NO+O2⇌2NO2△H<0 |
|
| C. |
NO(g)+CO(g)⇌ |
|
| D. |
A2(g)+3B2(g)⇌2AB3(g)△H=﹣373.4KJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体体积的叙述正确的是( )
-A.-一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定的
-B.-不同的气体,若体积不同,则他们的分子数也不同
-C.-一定温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定的
-D.-气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有1mol/L CaCl2溶液0.5L,Cl﹣的物质的量浓度为 mol/L.
(2)标准状况下,33.6L的HCl所具有的物质的量为 mol,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为 mol/L.
(3)8gNaOH溶于 g水中,才能使每10个水分子中溶有一个钠离子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com