
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(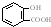 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: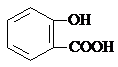 +HCO3-→ +HCO3-→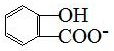 +CO2↑+H2O +CO2↑+H2O |
分析 A.氢氧化镁为中强碱,其碱性大于一水合氨,所以氢氧化镁与铵根离子反应生成一水合氨和镁离子;
B.二氧化硫与氢氧化钙溶液反应生成亚硫亚硫酸钙沉淀;
C.氢氧化钠过量,离子方程式按照碳酸氢钙的化学式组成书写;
D.羧基酸性大于碳酸、酚羟基的酸性小于碳酸,所以只有羧基发生反应.
解答 解:A.向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,氢氧化镁与铵根离子反应生成一水合氨和镁离子,反应的离子方程式为Mg(OH)2+2NH4+=2NH3•H2O+Mg2+,故A正确;
B.SO2通入澄清石灰水中,产生亚硫酸钙沉淀,正确的离子方程式为SO2+Ca2++2OH-=CaSO3↓+H2O,故B错误;
C.向Ca(HCO3)2溶液中加入过量NaOH溶液,反应生成碳酸钙和碳酸钠,反应的离子方程式为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故C正确;
D.碳碳长期过量服用阿司匹林出现水杨酸(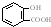 )反应,可静脉注滴NaHCO3溶液,只有羧基发生反应,该反应的离子方程式为
)反应,可静脉注滴NaHCO3溶液,只有羧基发生反应,该反应的离子方程式为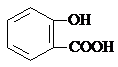
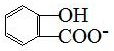 +CO2↑+H2O,故D正确;
+CO2↑+H2O,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确判断离子方程式正误常用方法,如难溶物、弱电解质的拆分是否正确、是否满足电荷守恒等,D为易错点,需要明确酚羟基、羧基与碳酸的酸性强弱.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:填空题
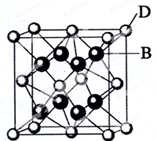 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应的反应热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应的反应热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | KClO3 | C. | MnO2 | D. | Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用环形玻璃搅拌棒是为了加快反应速率,使其充分反应,减小实验误差 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 在测定中和热实验中需要使用的仪器有量筒、烧杯、胶头滴管、温度计等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 Na<Mg<Al | B. | 酸性 H2SiO3<H2CO3<H2SO4 | ||
| C. | 稳定性 HF<HCl<HBr | D. | 碱性 NaOH<Mg(OH)2<Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中KC1O3的最大理论产量为1/7amol | |
| C. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=$\frac{1}{2}$ | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com