
接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是
( )
①尾气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥、炼铁 ④设置“废热”锅炉产生蒸汽,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
科目:高中化学 来源: 题型:
将1.12 g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,不显红色
C.Fe2+和Fe3+物质的量之比为6∶1
D.氧化产物和还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、S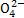 、Br-、C
、Br-、C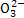 、HC
、HC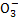 等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
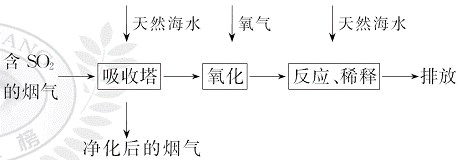
下列说法错误的是( )
A.天然海水pH≈8的原因是海水中的C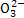 、HC
、HC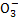 水解
水解
B.“氧化”是利用氧气将HS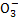 、S
、S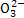 等氧化生成S
等氧化生成S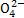
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D.“排放”出来的海水中S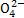 的物质的量浓度与进入吸收塔的天然海水相同
的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。
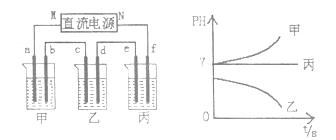
接通电源,经过一端时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
(3) 若电解后甲溶液的体积为25L,且产生的气体全部逸出。该溶液常温时的pH为 。
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com