
| A. |  1,3,4-三甲苯 | B. |  2-甲基-1-丙醇 | C. |  2-甲基-2-氯丙烷 | D. |  2-甲基-3-丁炔 |
分析 A、苯的同系物命名时,从简单的侧链开始编号,按顺时针或逆时针旋转,使侧链的位次和最小;
B、醇在命名时,要用羟基所在的碳原子的编号来表示羟基的位置;
C、氯代烃在命名时,要用氯原子所在的碳原子的编号来表示氯原子的位置;
D、炔烃在命名时,要从离官能团近的一端给主链上的碳原子编号.
解答 解:A、苯的同系物命名时,从简单的侧链开始编号,按顺时针或逆时针旋转,使侧链的位次和最小,故此物质的命名为1,2,4-三甲基苯,故A错误;
B、醇在命名时,选含官能团的最长的碳链为主链,故主链上有4个碳原子,从离官能团最近的一端开始编号,用羟基所在的碳原子的编号来表示羟基的位置,故此醇的名称为:2-丁醇,故B错误;
C、氯代烃在命名时,选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团最近的一端开始编号,用氯原子所在的碳原子的编号来表示氯原子的位置,故此醇的名称为:2-甲基-2-氯丙烷,故C正确;
D、炔烃在命名时,选含官能团的最长碳链为主链,从离官能团近的一端给主链上的碳原子编号,故此炔烃的名称为:3-甲基-1-丁炔,故D错误.
故选C.
点评 本题考查了苯的同系物、醇、氯代烃和炔烃的命名,难度不大,应注意的是苯的同系物在命名时,要从简单的侧链开始编号,按顺时针或逆时针旋转,使侧链的位次和最小


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
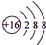 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.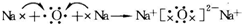 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是强酸,推出HF水溶液也是强酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. |  制备氢气并检验H2的可燃性 | |
| D. | 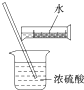 配制硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 已知溶液 | 大量存在的离子 |
| A | NH4HCO3溶液 | K+、Na+、NO3-、Cl- |
| B | FeCl3溶液 | Fe2+、NH4+、SCN-、SO42- |
| C | 中性溶液 | Cu2+、K+、Cl-、SO42- |
| D | CH3COOH溶液 | NH4+、Na+、SO42-、CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
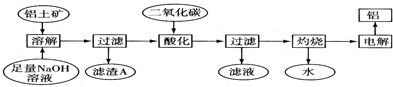
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com