
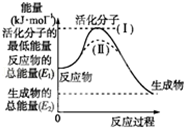
 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.分析 I.(1)依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响所以速率的元素分析判断;
II.根据反应热△H=反应物总键能-生成物总键能计算反应热.
解答 I解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量;△H=E2-E1;
故答案为:放热;需要;E2-E1 ;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;
故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂;故答案为:最有可能使用了催化剂;
(1)放热;需要;E2-E1;(2)409.0KJ/mol;(3)使用催化剂.
II.反应热△H=反应物总键能-生成物总键能,所以对于S(s)+3F2(g)═SF6(g),其反应热△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,
故答案为:-1220kJ/mol.
点评 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛不能与Br2发生加成反应 | |
| B. | 橙花醛能发生银镜反应 | |
| C. | 1 mol橙花醛最多可以与2 mol H2发生加成反应 | |
| D. | 橙花醛是乙烯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
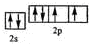 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
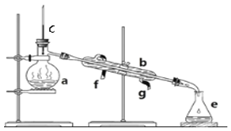 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;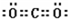 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.93g | B. | 3.51g | C. | 4.00g | D. | 5.85g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com