


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验事实 | |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气. |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用. |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解. |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2. |
| 事实五 | 1g(0.036mol)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL). |
查看答案和解析>>
科目:高中化学 来源: 题型:
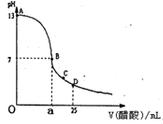
| A、c(OH-)一定大于c(CH3COO-) |
| B、c(OH-)一定小于c(CH3COO-) |
| C、c(OH-)一定等于c(CH3COO-) |
| D、上述三种情况都可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验器材 | 相应实验 |
| A | 坩埚、玻璃棒、酒精灯、泥三角 | 从食盐水中获得NaCl晶体 |
| B | 漏斗、滤纸、烧杯、玻璃棒 | 除去氢氧化铝胶体中的泥沙 |
| C | 分液漏斗、烧杯 | 利用四氯化碳萃取溴水中的溴 |
| D | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 | 用MnO2和浓盐酸制取干燥、纯净的氯气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、参加反应的氯气的物质的量等于
| ||||||||
B、若某温度下,反应后
| ||||||||
C、改变温度,产物中KC1O3的最大理论产量为
| ||||||||
D、改变温度,反应中转移电子的物质的量ne的范围:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
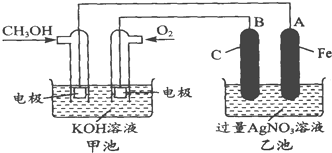
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com